
👉教師紹介・料金
※授業料1回1,500円+交通費(コミコミ最大3,000円)・入会金なし・お好きな日時に受講・3回のお試し期間あり(無料教材あり)
■総合ABC範囲表
>>【最新版】総合ABC範囲表
■総合A過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年
■総合B過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年、2015年
■総合C過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年、2015年
■総合ABC道コン偏差値
>>総合ABC道コン偏差値(SS)推移
☆過去問ダウンロードはこちら☆
※生徒以外で過去問のみをお求めの方は、こちらにご連絡ください(過去問の「原本」を頂ける方は歓迎します!)。
👉お問い合わせ
中学3年北海道学力テスト総合B「理科」(2023年)の難易度:昨年並み
2023年の総合B理科の難易度は、「昨年並み」と評価します。
つまり、易しいということです。
具体的には、非常に易しかった2019年以前の総合ABCのレベルです。
標準レベル問題集『中学 理科 標準問題集』が仕上がっていれば、満点近く取れたはずです。
入試のゴールである 『塾技 理科80』が吸収できていれば、30分かからず満点が取れたことでしょう。
今回の総合B理科は難しかったみたいですが、2年前にあった総合C理科はこれより何倍も難しいです。そのはるか上を行くのが、今年の公立高校入試です。
>>2021年総合Cの「理科」の問題・解答・詳しい解説 ★難しい★
非常に易しかった2019年の道コンSS50の得点が60点で2023年が47点なので、北海道の中学生の学力がこの分だけ下がったと言えます。
原因はここでは言いませんが、このレベルなら80点以上は欲しいので、問題集を活用して演習に励んで頂きたいところです。
中学3年北海道学力テスト総合B「理科」(2023年)の平均点・道コン偏差値SS
<総合B「理科」の平均点と道コン偏差値(2023年)>
47点
※道コンSS50に相当
中学3年北海道学力テスト総合B「理科」(2023年)問題・解答・解説
大問1 ばねの性質

問1
解答:160g
解説:
問題文の条件より、1N/100gが成り立ちます。
①において、ばねを50g×(1N/100g)=50/100N=0.5Nの力で引くと2.5cm伸びたことから、このばねのばね定数は0.5/2.5[N/cm]=1/5[N/cm]です。
よって、ばねののびが8.0cmのときのばねにかかる力は、8.0cm×1/5[N/cm]=1.6Nなので、ばねを引く物体の質量は、
1.6N÷(1N/100g)=1.6×100=160g
問2
解答:木片と床の間に摩擦力がはたらいているから。(例)
解説:
ばねばかりが木片を引く力の大きさ[N]=ばねが木片を引く力の大きさ[N]+木片と床の間に働く摩擦力[N]、という関係が成り立ちます。
問1より、このばねのばね定数は1/5[N/cm]でばねののびが0.5cmであることから、ばねが木片を引く力の大きさは1/5[N/cm]×0.5cm=0.1Nです。
よって、ばねばかりが木片を引く力の大きさ[N]が0.5Nより、木片と床の間に働く摩擦力[N]は、0.5N-0.1N=0.4Nです。
問3
解答:0.1N
解説:
問2解説参照。
問4
解答:弾性力(弾性の力)
解説:
単純な知識問題なので、解説略。
弾性力と可塑性のちがいは、要チェックです。
大問2 酸化銅の炭素による還元
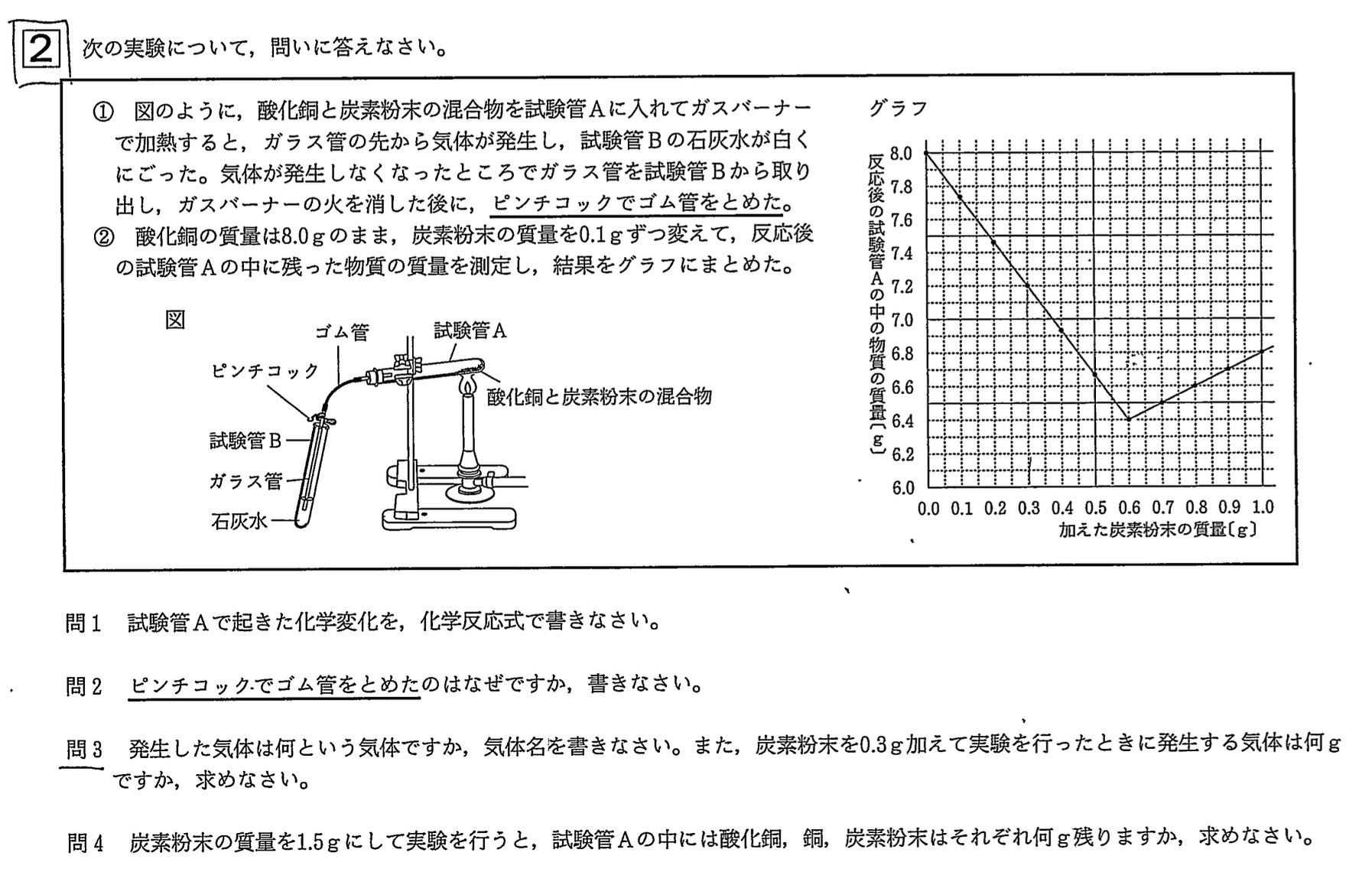
問1
解答:2CuO+C→2Cu+CO2
解説:
酸化銅と炭素が完全に反応すると、銅と二酸化炭素のみとなるので、まず以下のように書けます。
CuO+C→Cu+CO2
この化学反応式の左辺の酸素原子(O)の個数は1個、右辺の酸素原子(O)の個数は2個より、左辺の酸化銅(CuO)を2倍します。
2CuO+C→Cu+CO2
この化学反応式の左辺の銅原子(Cu)の個数は2個、右辺の銅原子(Cu)の個数は1個より、右辺の銅(Cu)を2倍します。
2CuO+C→2Cu+CO2
この化学反応式の左辺の炭素原子(C)の個数は1個、右辺の炭素原子(C)の個数は1個と個数がつり合っているので、化学反応式はこれでOKです。
問2
解答:銅が再び空気中の酸素と結びつくのを防ぐため。(例)
解説:
ガラス管の先を石灰水から抜いてからガスバーナーの火を消すのは、石灰水が逆流して加熱部に触れるのを防ぐためです。
石灰水が逆流する理由は、ガスバーナーの火を消すと試験管内部の温度が下がることで気圧が下がり、外の空気が取り込まれるためです。
同様に考えて、ガスバーナーの火を消す前にピンチコックでゴム管を止めないと、外の空気が取り込まれて、その空気に含まれる酸素が過熱部に触れることで、銅が酸素と結びついて(酸化されて)酸化銅に戻ってしまいます。
問3
解答:二酸化炭素 1.1g
解説:
酸化銅の炭素による還元によって、気体として二酸化炭素が発生します。
炭素原子と酸素原子との結びつきは、銅原子と酸素原子との結びつきより強いため、炭素原子が酸化銅の酸素原子を奪います。これにより、炭素は酸化され、酸化銅は還元されます。
グラフの折れ曲がった点より、酸化銅8.0gと炭素粉末0.6gの計8.6gが過不足なく全て反応して、6.4gの銅と2.2gの二酸化炭素が生じることが分かります。
炭素粉末を0.3g加えたとき、炭素粉末0.3gは完全に反応しますが、酸化銅8.0gは一部しか還元されません。
このとき生じる二酸化炭素の質量は、炭素粉末0.3g=0.6g×1/2より、2.2g×1/2=1.1gです。同様に考えて、生じた銅の質量は6.4g×1/2=3.2g、反応した酸化銅の質量は8.0g×1/2=4.0gです。
反応した酸化銅の質量(4.0g)+反応した炭素粉末の質量(0.3g)=生じた銅の質量(3.2g)+生じた二酸化炭素の質量(1.1g)、となり質量保存の法則を満たすので、上記の計算が正しいと確信が持てます。
問4
解答:酸化銅・・・0.0g、銅・・・6.4g、炭素・・・0.9g
解説:
グラフの折れ曲がった点より、酸化銅8.0gと炭素粉末0.6gの計8.6gが過不足なく全て反応して、6.4gの銅と2.2gの二酸化炭素が生じることが分かります。
よって、炭素粉末1.5gでは、酸化銅は完全に反応して6.4gの銅と2.2gの二酸化炭素が生じます。
炭素粉末1.5g>0.6gより、炭素粉末は0.9g余ります。
大問3 水酸化ナトリウム水溶液の電気分解

問1
解答:水に電流を流しやすくするため。(例)
解説:
この実験で用いた水は、不純物が含まれていない純水だという前提ではなしを進めます。
純水は水分子(H2O)のみでできており、イオンが存在しないことから、電流が流れません。
ここで、水酸化ナトリウム水溶液(NaOH)を加えると、電離式
NaOH→Na++OH–
より、水中にイオンが存在するため、電流が流れるようになります。
問2
解答:管A・・・水素、管B・・・酸素、+極側・・・(管)B
解説:
水酸化ナトリウム水溶液を電気分解すると、水が電気分解され、水素と酸素が同体積発生します。
問題文の条件より、点火によって管Aの体積が減少したことから、管Aで発生した水素が酸素と結びついたことが分かります。問題文に「管A、Bに少し空気が入った状態で」とあるので、管Aには酸素が含まれています。空気中の酸素の割合は約21%です。
水の電気分解のメカニズムは公立高校入試レベルを超えるので、以下のように考えてしまってよいでしょう。
+どうし-どうしは反発し、+と-はくっつきます。
水素イオン(H+)は+の電気を帯びているため、-極(陰極)で水素が発生します。消去法で、+極(陽極)で酸素が発生します。
よって、管Aは-極(陰極)、管Bは+極(陽極)です。
問3
解答:電気分解
解説:
単純な知識問題なので、解説略。
大問4 塩化銅の電気分解 ★問3がやや難

問1
解答:電解質、電離のようす・・・(CuCl2→)Cu2++2Cl–
解説:
単純な知識問題なので、解説略。
問2
解答:ウ、オ
解説:
単純な知識問題なので、解説略。
問3 ★やや難
解答:
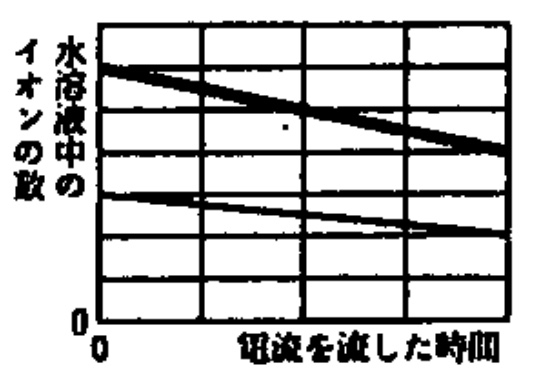
解説:
塩化銅の電離式、
CuCl2→Cu2++2Cl–
より、水に溶けた塩化銅のうち、銅イオン(Cu2+)と塩化物イオン(Cl–)の個数の比は1:2です。
これより、電流を流した時間が0のとき、塩化物イオン(Cl–)は3×2=6マスです。
塩化銅水溶液の電気分解のメカニズムを最小単位で考えると、塩化物イオン(Cl–)が陽極(+極)に引き寄せられて、電子2個を放出して陽極(+極)で塩素(Cl2)が発生します。
電圧が加えられているので、放出された電子2個は陰極(-極)へ移動します。電子が陰極(-極)から陽極(+極)に移動するため、陽極(+極)から陰極(-極)へ電流が流れます。電流は+の電気で、+極から-極へ電流が流れる事実と一致していることを、ここで確認してください。
陰極(-極)へ移動した電子2個を銅イオン(Cu2+)が受け取り、銅(Cu)が生じます。
よって、2個の塩化物イオン(Cl–)と1個の銅イオン(Cu2+)が反応した、つまり、1個の銅イオン(Cu2+)が減ると2個の塩化物イオン(Cl–)が減ると見ることができるので、電流を流した時間が4のとき、銅イオン(Cu2+)が3マスから2マスに減ることから、塩化物イオン(Cl–)は6マスから4マスに減ります。
大問5 マグネシウム・亜鉛・銅のイオン化傾向の比較実験

問1
解答:ウ
解説:
表より、亜鉛板に硫酸銅水溶液を入れると固体が付着することから、亜鉛板上に銅が析出しています。
これより、イオン化傾向(溶けやすさ)は、Zn(亜鉛)>Cu(銅)であることから、亜鉛が溶けて電子を放出し、硫酸銅水溶液中の銅イオンが電子を受け取り銅が析出したことが分かります。
問2
解答:無色から青色に変化する。(例)
解説:
③では、イオン化傾向(溶けやすさ)は、Cu(銅)>Ag(銀)であることから、銅が溶けて電子を放出し、硝酸銀水溶液中の銀イオンが電子を受け取り銀が析出したことが分かります。
銅が溶けて銅イオン(Cu2+)となり、銅イオン(Cu2+)は青色のもとであることから、水溶液は青色に変化します。
問3
解答:Mg(→)Zn(→)Cu(→)Ag
解説:
知識として、イオン化傾向は「Mg>Zn>Al>Fe>Cu>Ag」は覚えておきましょう。
その上で、問題文からイオン化傾向がこの順であることを、必ず確認してください。
表の亜鉛板:イオン化傾向は、亜鉛(Zn)>銅(Cu)です。
表のマグネシウム版:イオン化傾向は、マグネシウム(Mg)>亜鉛(Zn)、マグネシウム(Mg)>銅(Cu)です。
これらをまとめると、イオン化傾向は、マグネシウム(Mg)>亜鉛(Zn)>銅(Cu)です。
また実験③より、イオン化傾向は、Cu(銅)>Ag(銀)です。
これらをまとめると、イオン化傾向は、マグネシウム(Mg)>亜鉛(Zn)>銅(Cu)>Ag(銀)です。
大問6 植物の分類

問1
解答:ウ
解説:
Aグループは種子植物、Bグループは胞子で増える植物です。
ア:FとGグループを区別する基準です。
イ:区別する基準はありません。
ウ:消去法で正しい。
エ:DとEグループを区別する基準です。
問2
解答:基準・・・葉脈が網目状か平行か。(例)、結果・・・①、②(と)③、④
解説:
①②は双子葉類、③④は単子葉類です。
双子葉類と単子葉類を区別する基準は、葉脈が網状脈か平行脈か、主根と側根に分かれているかひげ根か、茎の維管束が形成層に沿って輪状に配列されているか散らばっているか、の3つがあります。
問3
解答:維管束
解説:
単純な知識問題なので、解説略。
大問7 地震の表計算 ★問4がやや難

問1
解答:初期微動継続時間
解説:
単純な知識問題なので、解説略。
問2
解答:18時8分10秒
解説:
表のA地点とB地点より、P波は48kmを8秒で進むので、P波の速度は48km/8s=6km/sです。
表のA地点より、P波は24kmを6km/sで進むので、地震発生からA地点にP波が到達するのにかかる時間は24km÷(6km/s)=4秒です。
よって地震発生時刻は、18時08分14秒 – 4秒=18時08分10秒です。
問3
解答:時間・・・変わらない。、震度・・・大きくなる。
解説:
マグニチュードは地震の規模を表し、2増えるとエネルギーが1000倍になるので、1増えると√1000=10√10≒10×3.2=32倍になります。
このエネルギーは揺れの大きさからくるものなので、マグニチュードが大きくなると震度は大きくなります。
P波とS波の大きさつまり地震の波形の振幅の高さは、マグニチュードが大きくなると大きくなります。
しかし、P波とS波の速度はマグニチュードによらず一定なので、各観測地点での初期微動継続時間は変わりません。
問4 ★やや難
解答:イ
解説:
『塾技 理科80』の例題(この問題集の中では易しめの問題)に、ほぼ同じ問題が載っています(>>『塾技 理科80』とは?対象者と使い方など)。
問題文の条件「ただし、この地震の震源はきわめて浅く、震央と震源の位置はほぼ等しく」より、震源距離の比=震央距離の比と考えてよいです。
また、震源距離の比=初期微動継続時間の比より、初期微動継続時間の比=震央距離の比が成り立ちます。
表より、各地点での初期微動継続時間の比は、A地点:B地点:C地点:D地点=2秒:6秒:8秒:10秒=1:3:4:5なので、
A地点の震央距離:B地点の震央距離:C地点の震央距離:D地点の震央距離=1:3:4:5です。
これを満たすのは、選択肢イです。
大問8 露頭を用いた地層の問題

問1
解答:浅くなっていった。(例)
解説:
C層→B層→A層と上に行くに従って粒が大きくなっていることから、海底の隆起により海の深さは浅くなったことが分かります。
問2
解答:年代・・・エ、理由・・・(火山灰を含む)B層がビカリアの化石を含むC層より上にあるから。(例)
解説:
図より、B層の砂岩は火山灰を含むことから、B層は火山噴火によって堆積したことが分かります。
ここでC層には新生代の示準化石であるビカリアが含まれており、B層はC層の上にあることから、新生代に火山灰が堆積後に沈降して砂が堆積してB層ができたと考えられます。
問3
解答:名前・・・示準(化石)、特徴・・・エ
解説:
単純な知識問題なので、解説略。
大問9 乾湿計 ★問2がやや難

問1
解答:気温・・・20.0(℃)、湿度・・・72%、天気・・・晴れ
解説:
気温=乾球の示度=湿級の示度+乾球と湿球の示度の差=17.0℃+3.0℃=20.0℃
表1より、乾球の示度が20.0℃、乾球と湿球の示度の差3.0℃のときの湿度は、72%です。
また図2より、雲が占める割合である雲量が8ほどから、天気は晴れです。
問2 ★やや難
解答:イ
解説:
問1より、観測時刻での気温は20.0℃、湿度は72%=0.72です。
表2より、気温20.0℃での飽和水蒸気量は17.3g/m3より、水蒸気量は17.3g/m3×0.72≒12.5g/m3です。
表2より、気温14.0℃での飽和水蒸気量は12.1g/m3、気温16.0℃での飽和水蒸気量は13.6g/m3より、12.1g/m3(14.0℃)<12.5g/m3<13.6g/m3(16.0℃)から、観測時刻の気温は14.0℃〜16.0℃だと考えられます。
問3
解答:①・・・イ、②・・・・ア
解説:
湿度が高いほど湿級のガーゼは蒸発しにくいため、周囲から気化熱をあまり奪わないことから、湿球の温度はあまり下がりません。つまり、乾球と湿球の示度の差は小さくなります。
大問10 植物の有性生殖

問1
解答:27g
解説:
加える水の質量をx(g)とすると、質量パーセント濃度の公式より、
3/(3+x)×100=10
3+x=3×10=30
∴x=27(g)
問2
解答:めしべの先端・・・柱頭、X・・・花粉管
解説:
単純な知識問題なので、解説略。
問3
解答:精細胞
解説:
単純な知識問題なので、解説略。
問4
解答:イ、エ
解説:
明らかに、以下の式が成り立ちます。
B=1/2A、A=C(選択肢イ)すなわち、B=1/2C(選択肢エ)
大問11 遺伝 ★問4がやや難

問1
解答:対立形質
解説:
単純な知識問題なので、解説略。
問2
解答:減数分裂
解説:
単純な知識問題なので、解説略。
問3
解答:顕性・・・赤色、遺伝子・・・Aa
解説:
子の代に赤色と白色の両方の形質が発現しているので、赤色の花Xの遺伝子型はAaです。もう片親の遺伝子型は図より純系だからAAまたはaaです。
Aaとaaの交配では、Aa×aa→Aa、Aa、aa、aa、となり、異なる形質を持つ子が出現し図と矛盾するので不適です。
AaとAAの交配では、AA×Aa→AA、Aa、AA、Aa、となり、すべて同じ形質の子が出現するので適しています。
以上より、顕性性質を示す遺伝子Aは赤色を発現させる遺伝子、潜性性質を示す遺伝子aは白色を発現させる遺伝子であるので、顕性性質は赤色で、赤い花Xが持つ遺伝子の組み合わせはAaです。
問4 ★やや難
解答:0%
解説:
問3より、赤色の花Xの遺伝子型はAaで、もう片親の遺伝子型はAAです。顕性性質を示すのは遺伝子Aです。親の代の交配パターンは、以下のとおりです。太字は赤色の花Xの遺伝子です。
Aa×AA→AA、AA、Aa、Aa
このうちの
白色の花の純系の遺伝子型はaaです。赤色と白色の両方の形質が発現しているので、子の代の遺伝子型はAaです。これより交配パターンは、以下のとおりです。
Aa×aa→Aa、Aa、aa、aa
太字は赤色の花Xの遺伝子で、赤色の花Zの遺伝子Aaには赤色の花Xの遺伝子が受け継がれていないことが分かります。
よって、確率は0%です。