第1問
(1)
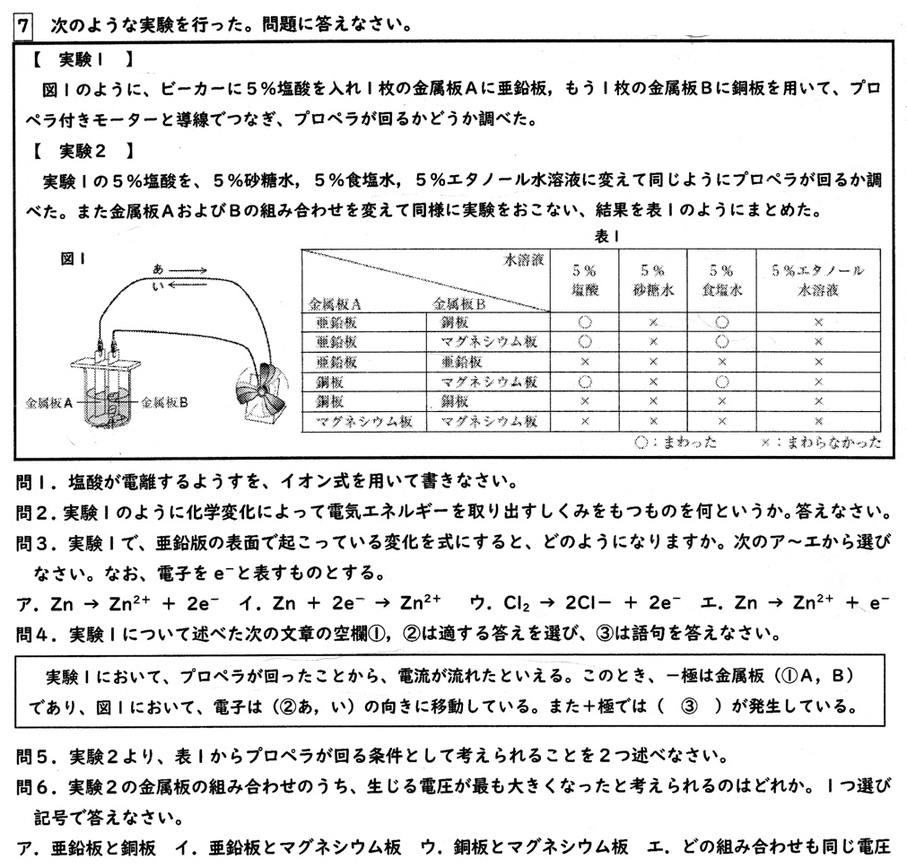
塩酸の電離式は、
HCl→H++Cl–
(2)
実験1はボルタの電池で、このように2種のイオン化傾向の異なる金属と電解質の水溶液を用いて電気エネルギーを取り出す装置を、化学電池といいます。
(3)
亜鉛は銅よりイオン化傾向が大きいので、酸に溶けて電子を放出します。
反応式は、
Zn→Zn2++2e–
(4)
亜鉛板から電子が放出されたことから、亜鉛板が-極、銅板が+極です。
電子は亜鉛板から銅板に流れ、電子の向きと電流の向きは逆向きなので、電流は銅板から亜鉛板に流れます。
(5)
化学電池は、2種のイオン化傾向の異なる金属と電解質の水溶液が必要です。
(6)
イオン化傾向の差が大きい金属ほど電圧が大きく、オームの法則より電流も大きくなります。
選択肢ですと、イオン化傾向の大きさは、Mg>Zn>Cuより、マグネシウム板と銅板の組み合わせが生じる電圧が最も大きくなります。
第2問

(1)(2)
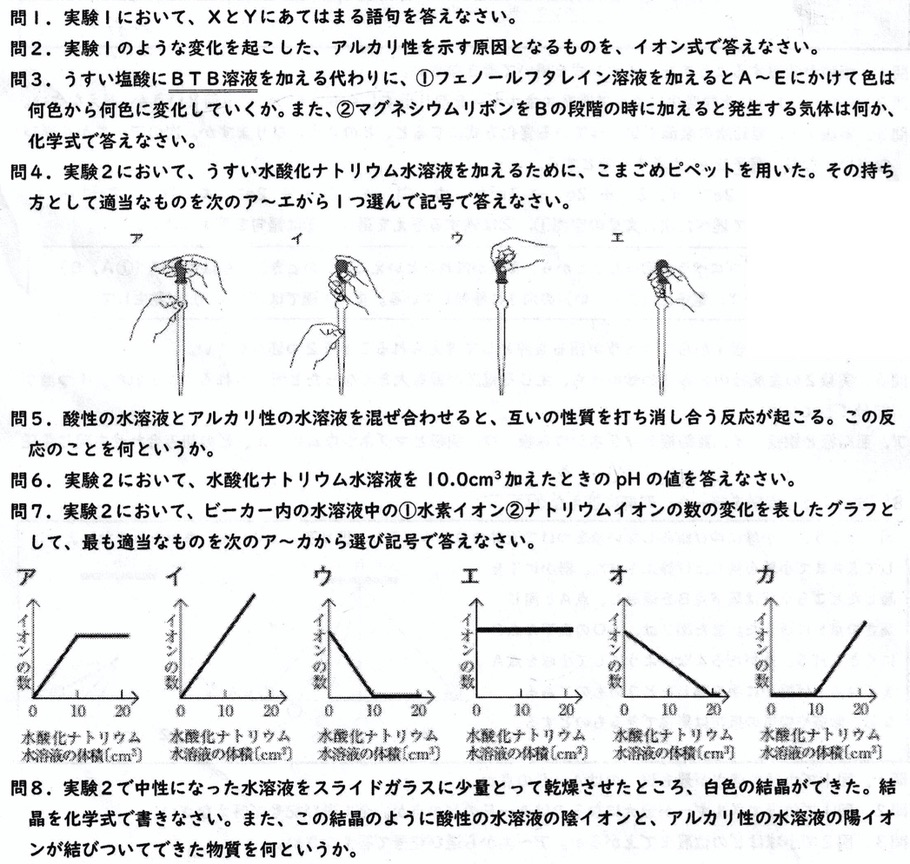
水酸化物イオンの移動実験では、水酸化物イオン(OH–)は陽極へ移動し、PH試験紙の色を青色に変化させます。
試薬の色が変化するのは、水酸化物イオン(OH–)がアルカリ性の性質を示すためです。
(3)
①
中和が起こらなくなるD以降、水酸化物イオン(OH–)が存在するため、フェノールフタレイン溶液の色は無色から赤色に変化します。
②
中和が起こらなくなるD以降、水素イオン(H+)が存在しないため、マグネシウムが溶けて水素(H2)が発生しなくなります。
(4)
答:エ(解説略)
(5)
答:中和(解説略)
(6)
BTB溶液の色が緑色より、水溶液は中性であるので、pHは7です。
(7)
①
中和が起こっているAからCまで、水素イオンの数は傾き-1の直線で減っていき、中和が起こらなくなるD以降、数が増えないので、答えはウです。
②
水酸化ナトリウムを1回加えると1個増えるので、原点を通る傾き1の直線となります(答えはイ)
(8)
うすい塩酸は水酸化ナトリウムと反応して、塩として塩化ナトリウム(食塩)(NaCl)が発生します。
塩化ナトリウムは、温度による溶解度の変化が小さいため、再結晶の方法として蒸発させます。
スポンサーリンク
第3問

(1)
答:ウ
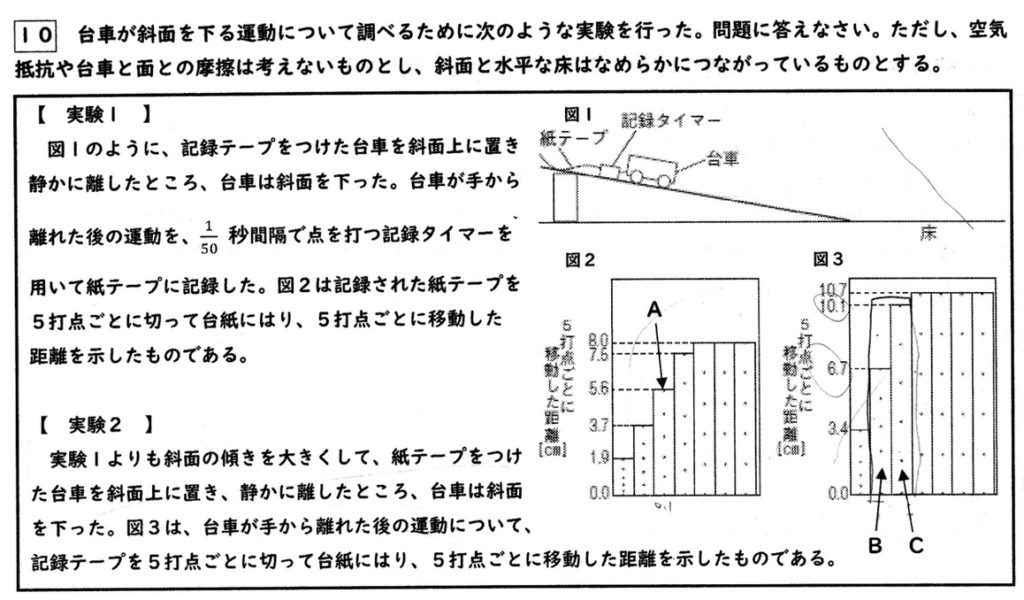
重力の大きさと向きは、場所によらず一定です。
(2)
台車に働く重力の斜面方向の分力は、重力の大きさが一定なので一定です。
(3)
斜面の傾きを大きくすると、台車に働く重力の斜面方向の分力が大きくなり、速さの増え方が大きくなります。
変化の割合=直線の傾きより、
解答例:実験2は実験1より斜面の傾きが大きいため、速さの変化の割合が大きくなるから。
(4)
テープ1枚が0.1sで、Aのテープの長さが5.6cmより平均の速さ(cm/s)は
5.6cm÷0.1s=56cm/s
(5)
BとCの2枚のテープの長さの合計は16.8cmより、平均の速さ(cm/s)は
16.8cm÷0.2s=168/2=84cm/s
(6)(7)
等速直線運動をしており、水平方向に力が働いていない(ウ)ことから、台車は摩擦のない水平な床を運動していることが分かります。
第4問
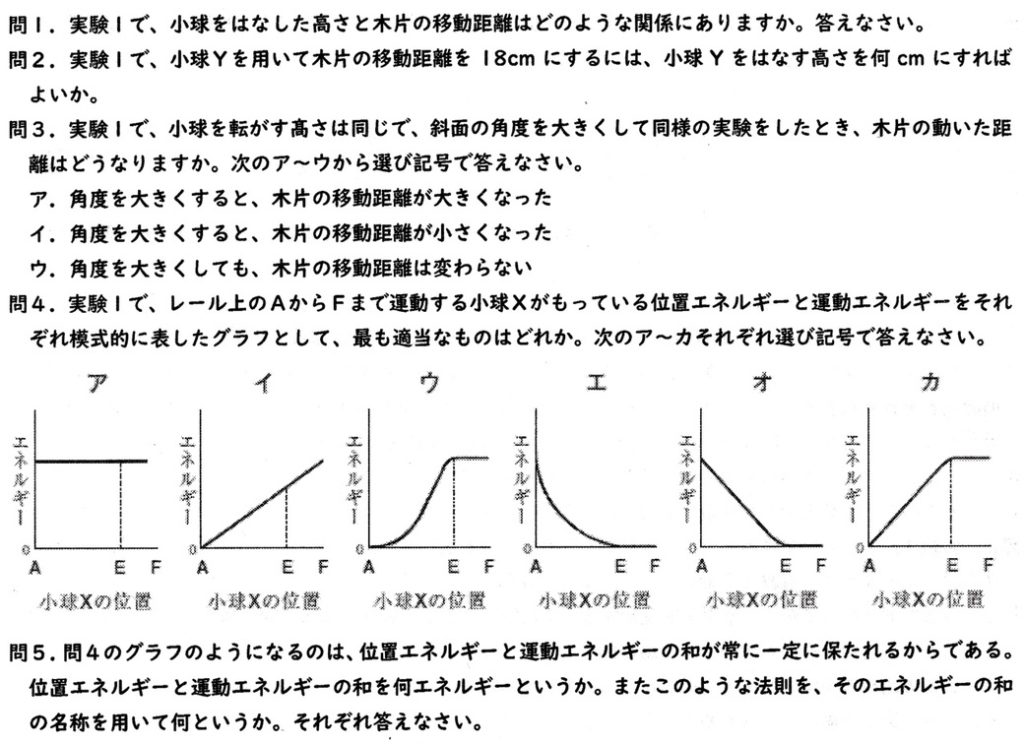
(1)
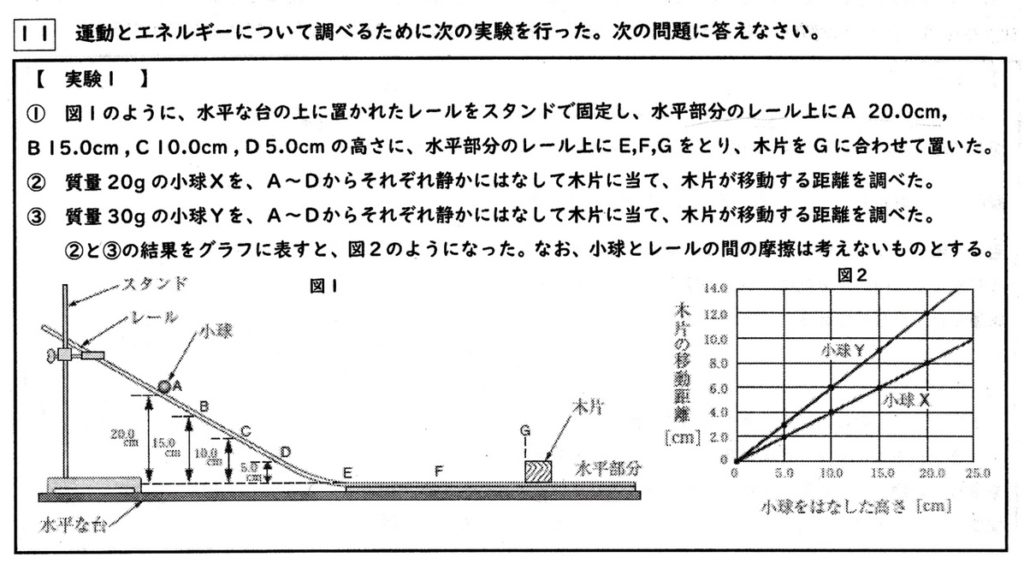
図2より、比例の関係にあることが分かります。
位置エネルギ=重力×垂直方向の高さ=(小球の質量×重力加速度)×垂直方向の高さ ※重力加速度=1N/100gまたは0.98N/100g
で、位置エネルギは高さに比例することから、小球を離す高さが高いほど位置エネルギが大きくなり、水平部分の運動エネルギーも大きくなって、それだけ木片を長く動かします。
(2)
図2の小球Yのグラフの傾きは0.6より、y=0.6xとなります。
y=18を代入して、x=18/0.6=180/6=30cm
※比例より、6:10=18:x=18:30となり、x=30cm
(3)
高さが同じなら位置エネルギが同じで運動エネルギーも同じなので、木片の移動距離は変わりません。
(4)(5)
位置エネルギ+運動エネルギー=力学的エネルギー=一定より、
・位置エネルギ
A点では高さが最大、斜面を下っているので直線的に減少していき、E・F区間は高さが0より0なので、オです。
・運動エネルギー
A点では速さが0より0。斜面を下っているので直線的に増加していき、E・F区間は位置エネルギと等しくなり一定となるので、カです。