第1問
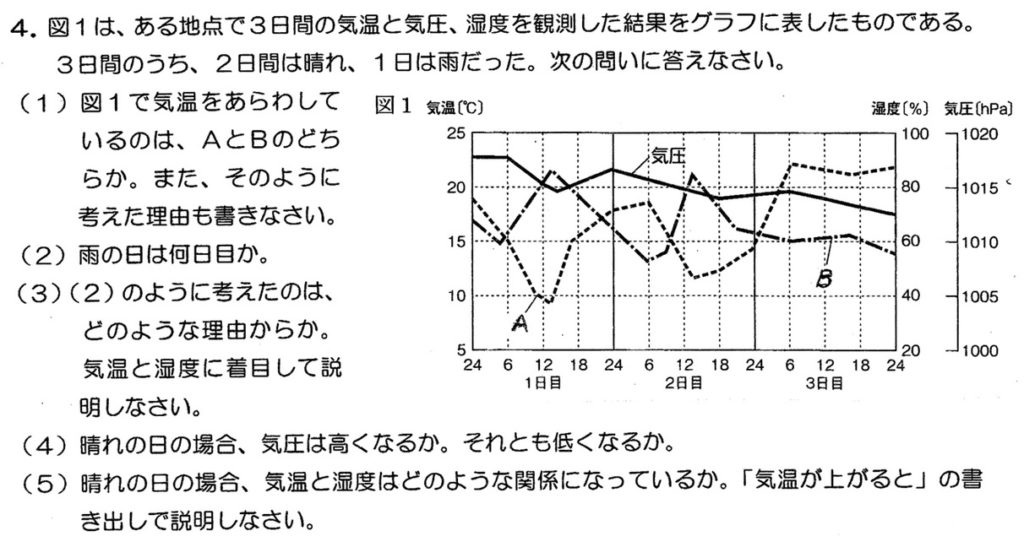
(1)
2日間が晴れで、晴れの日は日照のため気温が高く飽和水蒸気量(g/m3)も高いため、湿度は低いです。
これより、気温が高い日が2日、湿度が低い日が2日あることから、Aが湿度、Bが気温です。
(2)(3)
雨の日は日照がなく気温が低く飽和水蒸気量(g/m3)も低いですが、水蒸気量(g/m3)が多いため、湿度は高くなります。
これより、図1で湿度が85%付近と維持している3日目が雨であると考えられます。
(4)(5)
高気圧は下降気流のため、気圧が上がり空気が断熱圧縮されて気温が上がり飽和水蒸気量(g/m3)も上がるため湿度が下がり、雲が消えて天気が良くなります。
よって、晴れの日は気圧が高くなります。
スポンサーリンク
第2問
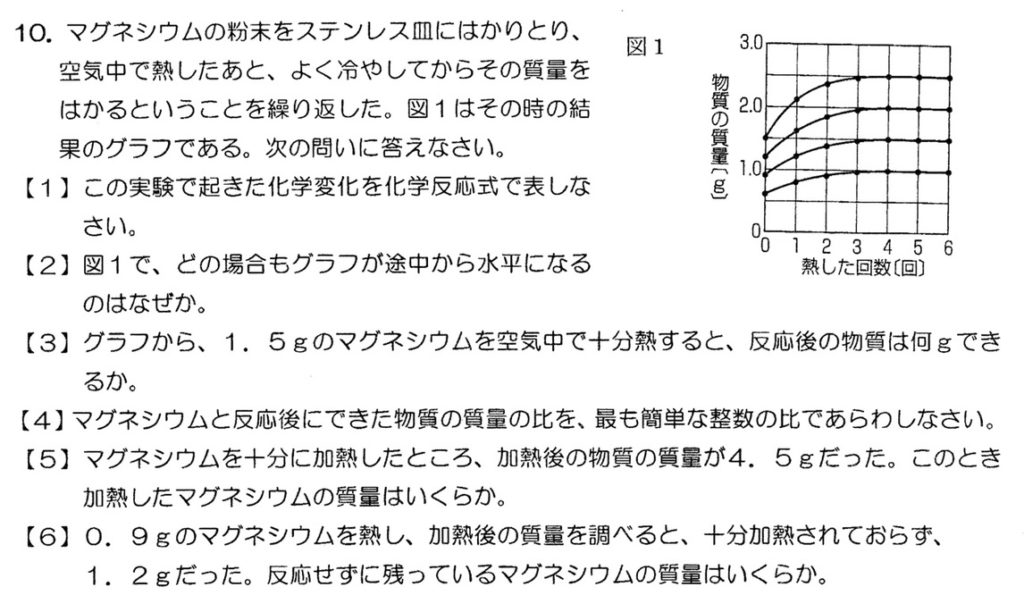
(1)
マグネシウムの燃焼の化学反応式は、以下の通りです。
2Mg+O2→2MgO
(2)
マグネシウムを加熱すると、空気に触れていない部分は酸化されませんが、かき混ぜて加熱を繰り返すと、全て酸化されて質量が増加しなくなります。
(3)(4)
定比例の法則により、マグネシウムの燃焼では、マグネシウム:酸素:酸化マグネシウム=3:2:5の質量比が成り立つので、
マグネシウム:酸素:酸化マグネシウム=3:2:5=1.5:1:2.5となり、
1.5gのマグネシウムが過不足なく全て反応すると、酸化マグネシウムが2.5g生成します。
(5)
マグネシウム:酸素:酸化マグネシウム=3:2:5=2.7:1.8:4.5より、
2.7gのマグネシウムが過不足なく全て反応すると、酸化マグネシウムが4.5g生成します。
(6)
まず、0.3gの酸素が化合したことを抑えます。
マグネシウム:酸素=3:2より、0.3gの酸素と過不足なく全て反応するマグネシウムの質量は、0.3g×3/2=0.9/2=0.45g
ゆえに、0.9gのマグネシウムのうち0.45gが過不足なく全てしているので、未反応のマグネシウムの質量は0.45g(0.9g – 0.45g)となります。
スポンサーリンク
第3問

(1)
答:化合物(解説略)
(2)
定比例の法則により、銅の酸化において、銅:酸素:酸化銅=4:1:5の質量比が成り立ちます。
この比例式は、過不足なく全て反応した場合のものですが、問題文に「銅の一部が酸素と化合して」とあるので、銅は過不足なく全て反応していないことが分かります。
しかし、酸素が0.04g化合したことが分かるので、比例式より、銅:酸素:酸化銅=4:1:5=0.16:0.04:0.20となり、
混合物中には、酸化銅が0.20g、未反応の銅が0.24g(0.40g – 0.16g)含まれています。
(3)
鉄など、酸素との結びつきが強い金属(イオン化傾向が大きい金属)は、空気中の酸素と結びつき、酸化してさびます。
さびると脆くなって危険なので、外気に触れないようペンキなどを塗ります。
(4)
銅の酸化の化学反応式は、以下の通りです。
2Cu+O2→2CuO
この化学反応式を6倍すると「12Cu+6O2→12CuO」となり、酸素分子が4個余ります。
この化学反応式を10倍すると「20Cu+10O2→20CuO」となり、銅原子が10個不足するので不適です。
よって、銅原子が完全に反応して、酸素分子が4個余ります。
第4問(難)

(1)
閉鎖系での実験なので、質量保存の法則より、反応前の容器全体の質量(m)=反応後の容器全体の質量(n)、となります。
(2)
①
開放系での実験なので、発生した二酸化炭素の分だけ質量が減少します。
ゆえに、反応前の容器全体の質量(m)>反応後の容器全体の質量(n)、となります。
②③
一定量なのがうすい塩酸20cm3で、質量が変わるのが炭酸水素ナトリウムなので、発生する二酸化炭素の質量はうすい塩酸の体積に依存します。
表1より、EとFでは質量の変化がないので、5.0gの炭酸水素ナトリウムと、この濃度のうすい塩酸20cm3が過不足なく全て反応すると、二酸化炭素が2.3g発生することが分かります。
しかしFでは炭酸水素ナトリウムが1.0g余っているので、この濃度のうすい塩酸を4.0cm3加えることで、二酸化炭素が0.5gさらに発生します。