第1問

(1)
純粋な水は分子として存在しており、電流が流れにくいです。
そこに電解質である水酸化ナトリウムを加えることで、水溶液中にイオンが加わり、電流が流れやすくなります。
(2)(3)
水の電気分解では、陽極では酸素(化学式O2)、陰極では水素(化学式H2)が発生します。
(4)(5)
水の電気分解の化学反応式は、
2H2+O2→2H2O
電気分解により発生する水素と酸素の体積比は2:1なので、酸素が4ml発生したなら、水素は4ml×2=8ml発生します。
(6)
塩化銅は電解質の物質なので、水溶液中にイオンとして電離します。
水溶液中に含まれる銅イオンにより、塩化銅水溶液は青色を呈します。
塩化銅の電気分解の化学反応式は、
CuCl2→Cu+Cl2
スポンサーリンク
第2問
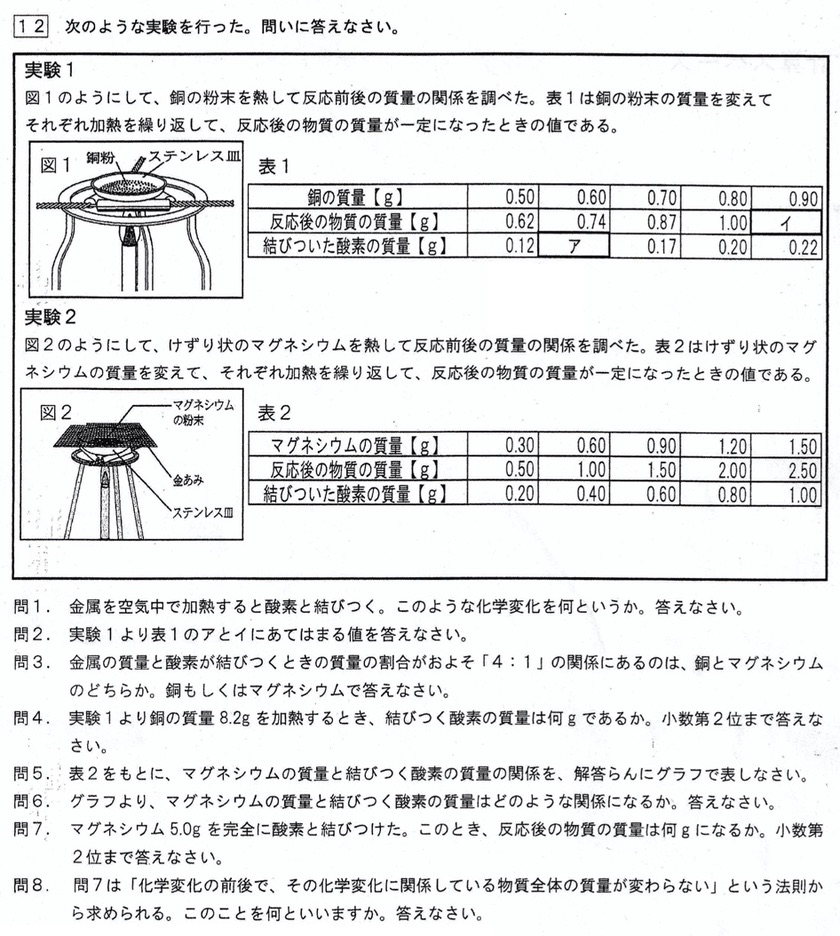
(1)
答:酸化(解説略)
(2)
質量保存の法則より、
ア:0.74g-o.60g=0.14g
イ:0.90g+0.22g=1.12g
(3)
答:銅(解説略)
(4)
銅と過不足無く全て反応する酸素の質量比は4:1より、8.2gの銅と過不足無く全て反応する酸素の質量は、8.2g×1/4=2.05g
(5)
縦軸を化合する酸素の質量、横軸を反応するマグネシウムの質量として表2の値をプロットするだけです。
(6)
定比例の法則より、比例の関係が成り立ちます。
(7)
マグネシウムの質量と過不足無く全て反応する酸素の質量比は3:2より、マグネシウム:酸素:酸化マグネシウム=3:2:5の質量比の関係が成り立ちます。
5.0gのマグネシウムが過不足無く全て反応した場合、発生する酸化マグネシウムの質量は、5.0g×5/3=25/3=8.333・・・≒8.33g
(8)
答:質量保存の法則(解説略)
スポンサーリンク
第3問
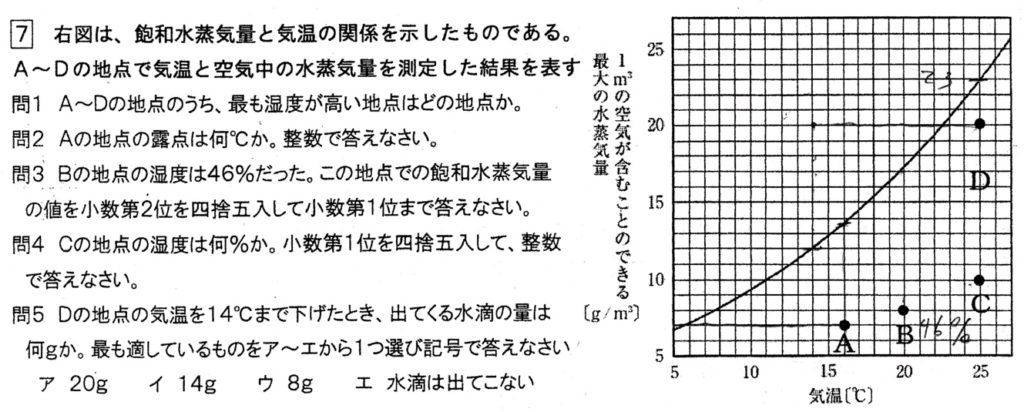
(1)
飽和水蒸気量曲線との距離が最も近い地点を選べばよいので、答はDです。
(2)
A地点の温度を16℃から下げていき飽和水蒸気量曲線上にある温度が露点より、答は6℃です。
(3)
B地点の温度20℃の水蒸気量は8g/m3より、飽和水蒸気量は、8g/m3÷46%=8/0.46=800/46=400/23=17.39・・・≒17.4%
(4)
C地点では、水蒸気量が10g/m3、飽和水蒸気量が23g/m3より、湿度は10/23×100=1000/23=43.47・・・≒44%
(5)
D地点の蒸気量は20g/m3、14℃における飽和蒸気量は12g/m3より、8g/m3の水滴が発生すると考えられます。
第4問
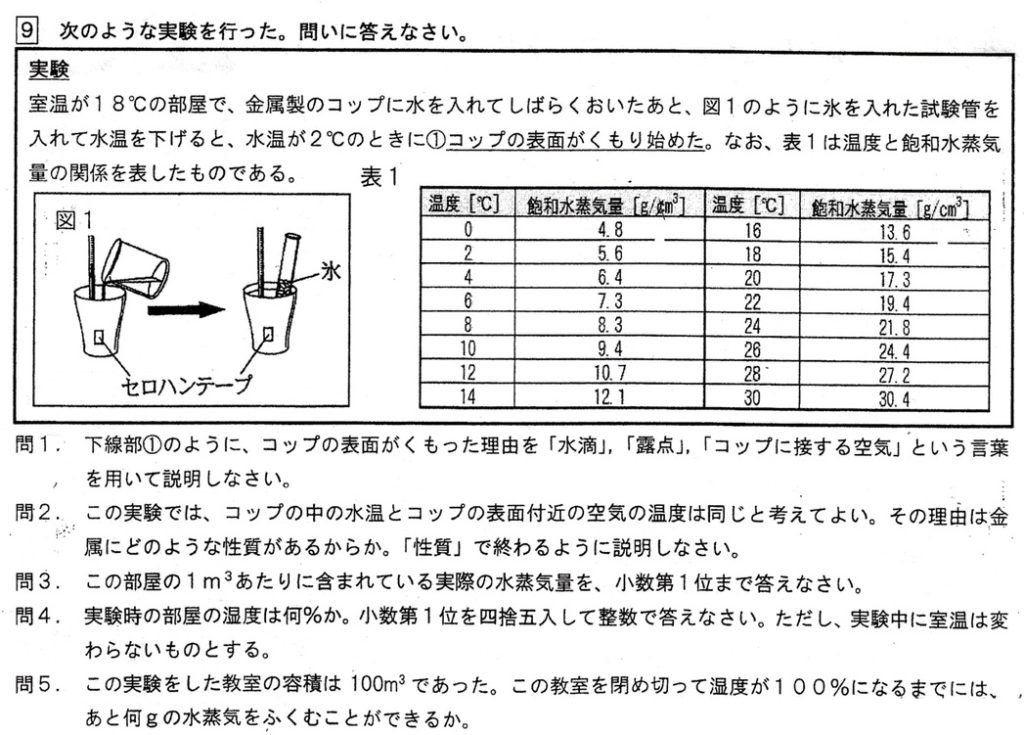
(1)
解答例:コップの中の水とコップに接する空気が露点に達し、水蒸気が水滴となって現れたから(解説略)
(2)
解答例:熱をよく伝える性質(解説略)
(3)
露点とは、空気中に含まれる水蒸気量のことなので、水温2℃のときの水蒸気量5.6g/m3が空気中に含まれる水蒸気量です。
(4)
18℃における飽和水蒸気量は15.4g/m3、水蒸気量は5.6g/m3より、湿度は5.6/15.4×100≒36%
(5)
18℃における飽和水蒸気量は15.4g/m3、水蒸気量は5.6g/m3より、あと9.8g/m3の水蒸気を含むことができます。
100m3では、9.8g/m3×100m3=980gの水蒸気を含むことができます。