第1問
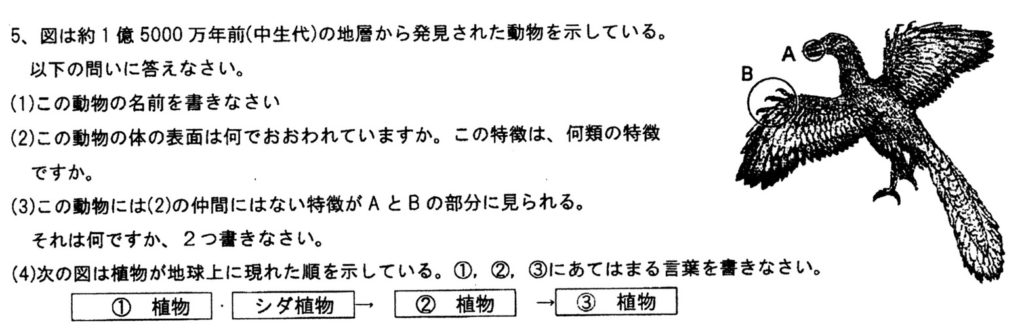
(1)
答:始祖鳥(解説略)
(2)(3)
始祖鳥は、中生代に栄えた鳥類とは虫類の両方の特徴を持つ動物です。
鳥類の特徴は、①羽毛を持ちくちばしがある、前足の骨格がつばさとよく似ている
は虫類の特徴は、①くちばしに歯(A)、つばさに爪がある(B)、②尾骨のある長い骨をもつ
(4)
植物の進化の道すじは、コケ植物→シダ植物→裸子植物→被子植物、と考えられています。
第2問

(1)
答:酸化還元反応(解説略)
(2)
酸化銅の水素による還元の化学反応式は、以下の通りです。
CuO+H2→Cu+H2O
スポンサーリンク
第3問

(1)
銅の酸化において、過不足無く全て反応する銅と酸素の質量比は4:1より、0.8gの銅と過不足無く全て反応する酸素の質量は、0.8g×1/4=0.2g
(2)
銅の酸化において、過不足無く全て反応する銅と酸素の質量比は4:1より、銅:酸素:酸化銅=4:1:5、の質量比の関係が成り立ちます。
ゆえに、酸化銅1.5gに含まれる銅の質量は、1.5g×4/5=0.3×4=1.2g
(3)
マグネシウムの燃焼において、過不足無く全て反応するマグネシウムと酸素の質量比は3:2より、マグネシウム:酸素:酸化マグネシウム=3:2:5、の質量比の関係が成り立ちます。
ゆえに、酸化銅3.0gに含まれる銅の質量は、3.0g×3/5=0.6×3=1.8g
(4)
4.1gの銅と酸化銅の混合物は、3.6gの銅に0.5gの酸素が化合したことが確実に言えます。
0.5gの酸素と過不足無く全て反応する銅の質量は、0.5g×4=2.0gより、未反応の銅は1.6g(3.6g-2.0g)です。
また、銅:酸素:酸化銅=4:1:5より、0.5gの酸素が過不足無く全て反応した場合、酸化銅は0.5g×5=2.5g発生するので、4.1gの銅と酸化銅の混合物中に、未反応の銅が1.6g(4.1g-2.5g)含まれていることが分かります。
(5)
質量比は、銅:酸素=4:1=8:2、マグネシウム:酸素=3:2より、銅:マグネシウム:酸素=8:3:2となります。
第4問

(1)
炭酸水素ナトリウムにうすい塩酸を加えると、気体として二酸化炭素が発生します。
容器はフタがされていない開放系であるので、発生した二酸化炭素分だけ全体の質量が減少するので、発生した二酸化炭素の質量は、
31.00g-30.48g=0.52g
(2)
うすい塩酸の体積が変化しますが、炭酸水素ナトリウムの質量が1.00gと一定であるので、発生する二酸化炭素の質量は炭酸水素ナトリウムの質量によって決められます。
(3)
解答例:反応の前後で、原子の種類と数が変化しないため(解説略)