第1問
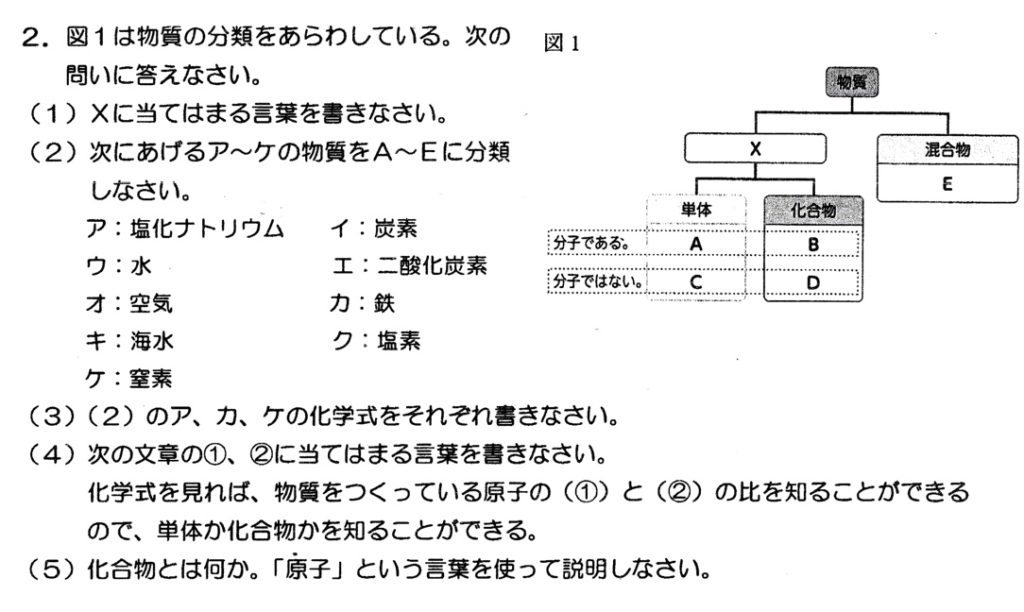
(1)
答:純物質(解説略)
(2)(3)
ア:塩化ナトリウム(NaCl)は金属原子を含んでいるので、分子を作らない化合物です。
イ:炭素(C)は分子を作る単体です。
ウ:水(H2O)は分子を作る化合物です。
エ:二酸化炭素(CO2)は分子を作る化合物です。
オ:空気には、窒素(約78%)、酸素(約21%)、アルゴン(約0.9%)、二酸化炭素(約0.04%)などが含まれているので、混合物です。
カ:鉄(Fe)は金属原子より、分子を作らない単体です。
キ:海水は主に、水(H2O)と塩化ナトリウム(NaCl)からできているので、混合物です。
ク:塩素(Cl2)は分子を作る単体です。
ケ:窒素(N2)は分子を作る単体です。
(4)
周期表を見て、化学式から、物質をつくる原子の数と質量の比が分かります。
(5)
化合物とは、2種類以上の原子からなる純物質です。
第2問

(1)
鉄は磁石に引きつけられますが、硫化鉄は磁石に引きつけられないので、答えは筒Aです。
(2)
うすい塩酸を加えると、筒Aでは鉄と反応して水素が、筒Bでは硫化鉄と反応して硫化水素が、それぞれ発生します。
(3)
筒Bでは、鉄と硫黄の化合が起こっているので、化学反応式は、
Fe+S→FeS
(4)
ア:再結晶の手法の一つです。塩化ナトリウムは温度に対する溶解度の変化が小さいので、蒸発させて結晶を取り出します。
イ:酸化銀が別の物質に変化しているので、化学変化です。
ウ:状態変化です。氷→水より、体積は減少します。
エ:銅と硫黄の化合なので、化学変化です。
スポンサーリンク
第3問

(1)
純粋な水はイオンに電離しないため、電気分解をしても電子を放出する陰イオンがないので、電流が流れません。
そこで、電解質である水酸化ナトリウムを加えることで、電流を流れやすくします。
(2)
答:陽極(解説略)
(3)
水の電気分解により、陰極には水素が酸素の2倍発生します。
水素はマッチの火を近づけるとポンと音を立てて燃え(酸化されて)、水が発生します。
(4)
陽極には酸素が発生します。
酸素の発生法として、選択肢ウのような方法もあります。
(5)
酸素が10cm3発生しているので、水素は2倍の20cm3発生しています。
第4問

(1)
答:水上置換法(解説略)
(2)
答:はじめに集めた気体は試験管内の空気だから。(解説略)
(3)
炭酸水素ナトリウムの熱分解により発生した水が過熱部に触れ、急冷されて試験管が割れないようにするため、図のように試験管を傾けます。
(4)
加熱を止めると試験管内の空気が冷やされて気圧が下がり外気を吸うため、あらかじめガラス管の先を水そうから抜かないと、試験管内に水が逆流し、水が過熱部に触れ、急冷されて試験管が割れて危険です。
なので、試験管内に水が逆流しないようにするために、ガラス管の先を水そうから抜きます。
(5)
二酸化炭素が発生しているので、石灰水と反応して中和が起こって、水にとけにくい炭酸カルシウムの塩ができ、石灰水が白く濁ります。
さらに二酸化炭素を通し続けると、炭酸カルシウムは水にとけやすい炭酸水素カルシウムになり、水溶液は再び透明になります。
(6)
解答例:青色から赤色に変化する。(解説略)
(7)
①
水によくとけるのは、加熱後に発生した炭酸ナトリウムです。
②
加熱前の炭酸水素ナトリウムは水にとけにくく、水酸化物イオンをあまり放出しないため、弱アルカリ性の水溶液となり、フェノールフタレイン溶液を加えると、うすい赤色に変化します。
(8)
炭酸水素ナトリウム→炭酸水素ナトリウム(固体)+水(液体)+二酸化炭素(気体)