第1問

(1)
硫酸銅水溶液という名のとおり、水溶液です。
水溶液の溶媒(溶かすもの)は、水です。
(2)
水溶液中では、粒子は水の粒子に衝突しながら拡散しており、どの部分を取っても濃さ(質量パーセント濃度)が均一です。
よって、固体の硫酸銅を水に入れると、ア→エ→ウ→イの順に、かき混ぜなくても溶けていきます。
なお、硫酸銅水溶液は青色ですが、これは水溶液中に含まれる銅イオンの色です。
第2問(やや難)
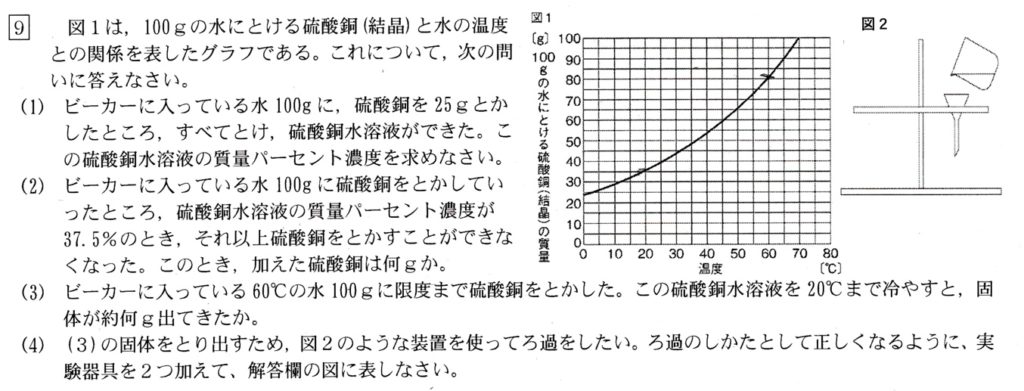
(1)
グラフより、水の温度が0℃のときの溶解度が約25gより、室温下では水100gに硫酸銅25gは全て溶けます。
このときの質量パーセント濃度ですが、水溶液125gに硫酸銅が25g含まれているので、水溶液の質量の1/5=0.2=20%が固体の硫酸銅で、これが質量パーセント濃度です。
(2)<やや難>
無理に解こうとせず、方程式を立ててて、いねいに解いていくのが近道です。
加えた硫酸銅の質量をx(g)とおくと、水溶液の質量100+x(g)の37.5%が硫酸銅の質量x(g)に相当するので、
37.5%×(100+x)=x ⇔ 0.375(100+x)=x ⇔ 375(100+x)=1000x ⇔3(100+x) =8x ⇔ 5x=3×100 ⇔ x=3×20
∴ x=60(g)
(3)
グラフより、
60℃における硫酸銅の溶解度は、約80g
20℃における硫酸銅の溶解度は、約35gより、
60℃の飽和水蒸気量を20℃に冷やすと、約45g(80g – 35g=45g)の硫酸銅が析出します。
(4)
液体中の固体をろ過するとき、
①液はガラス棒を伝わらせる
②ガラス棒の先はろ紙の3重部分に
③とがったろうとの先をビーカーのかべに
します。
①〜③の知識をもとに、作図して終わりです。
スポンサーリンク
第3問
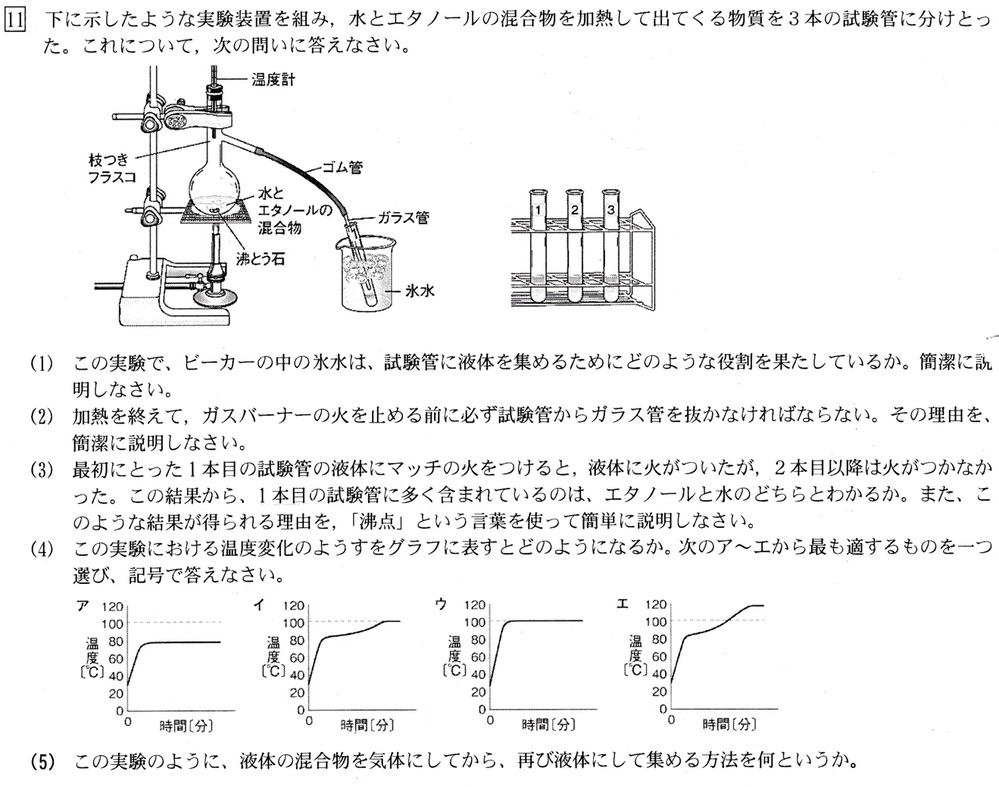
(1)
解答例:ガラス管から出てきた蒸気を冷やして液体にする役割を果たしている(解説略)
(2)
火を消すと枝つきフラスコ内部の温度が下がって内圧が下がり外気が取り込まれるので、試験管内部の液体が逆流するのを防ぐために、ガラス管の先を試験管から取り出してから火を消します。
(3)(5)
水とエタノールの混合物を加熱すると、純粋なエタノールの沸点(78.3℃)が純水の沸点(100℃)より低いため、エタノールが先に出てきます。
ゆえに、試験管1はエタノールを多く含む混合物、試験管2は水を多く含む混合物です。
試験管1にマッチの火を近づけると火がついたが、試験2以降は火がつかなかったことからも、試験管1がエタノールを多く含む混合物であると言えます。
このように、物質の沸点の違いを利用して液体の混合物を分ける(完璧には分離できない)方法を、蒸留といいます。
(4)
純粋なエタノールの沸点は78.3℃、純水の沸点は100℃より、混合物の状態変化のグラフは、78.3℃付近と100℃付近で一定になります。
よって、イが正解です。
第4問
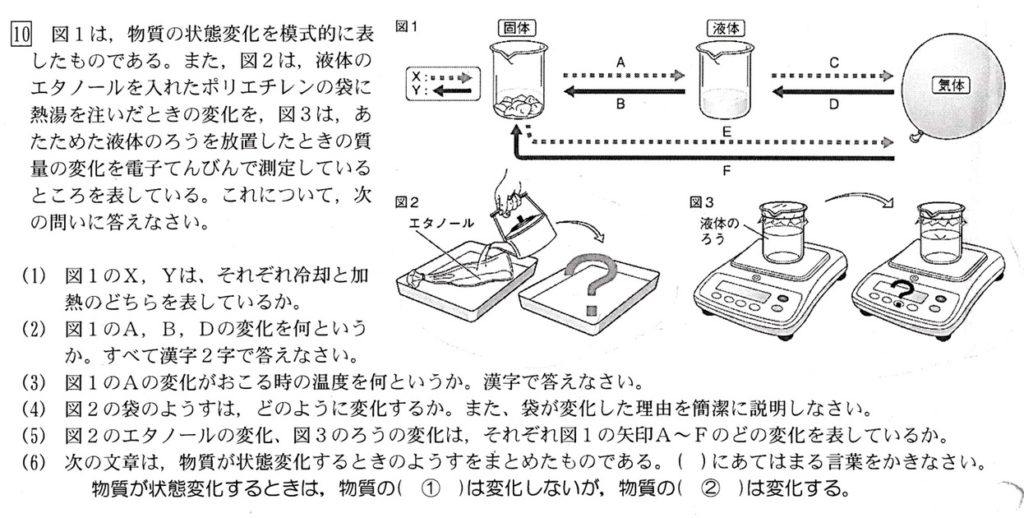
(1)
X:加熱、Y:冷却(解説略)
(2)
Aは融解、Bは凝固、Cは気化、Dは液化、EとFは昇華です。
(3)
答:融点(解説略)
(4)
純粋なエタノールの沸点は78.3℃、純水の沸点は100℃より、ポリエチレン(PE)にエタノールを注ぐと、エタノールは全て気体になり、体積が激増します。
(5)
エタノール:C、ろう(パルチミン酸):B(解説略)
(6)
状態変化では、物質の粒子の種類と数は変化しませんが、温度によって粒子の運動のようすが変化するため、物質の状態が変化します。
化学変化では、物質を構成する原子の種類と数は変化しませんが、原子の組み合わせが変わるので、別の物質に変化します。