第1問

(1)
水溶液150gに溶質である砂糖が30g溶けて粒子として均一に拡散しているので、質量パーセント濃度は水溶液150gの0.2倍=20%です。
(2)
水溶液150gの15%が溶質である砂糖の質量なので、150g×15%=150g×15/100=225/10=22.5g
(3)
水溶液150gの20%が溶質である砂糖の質量なので、砂糖の質量=150g×20%=150×0.2=15×2=30g、溶媒である水の質量=150g – 30g=120g
(4)
水溶液の質量=100g+200g=300g、砂糖の質量=100g×10%+200g×20%=10+40=50gより、質量パーセント濃度=50/300×100=50/3=16.66・・・≒16.7%
※質量パーセント濃度をxとおくと、100(x-10)=200(20-x) ⇔ x-10=40-2x ⇔ x=50/3≒16.7%と、てんびん算を用いて計算することもできます。
(5)
水溶液の質量を0.2倍した値が砂糖の質量なので、水溶液の質量=60g/0.2=60×5=300g。
これより水の質量は、300g – 60g=240g
(6)
水溶液300g+200g=500gに、砂糖が300g×20%=60g含まれているので、質量パーセント濃度=60/500×100=60/5=12%
※質量パーセント濃度をxとおくと、200(x-0)=300(20-x) ⇔ 2x=60-3x ⇔ x=60/5=12%と、てんびん算を用いて計算することもできます。
(7)
砂糖の質量は、Aが500g×5%=5×5=25g、Bが100g×20%=20gより、水溶液に含まれる砂糖の質量は、A>Bです。
(8)
質量パーセント濃度は、水溶液の質量が小さいほど、溶質である砂糖の質量が大きいほど大きい(濃い)ので、質量パーセント濃度は、A>Bです。
第2問
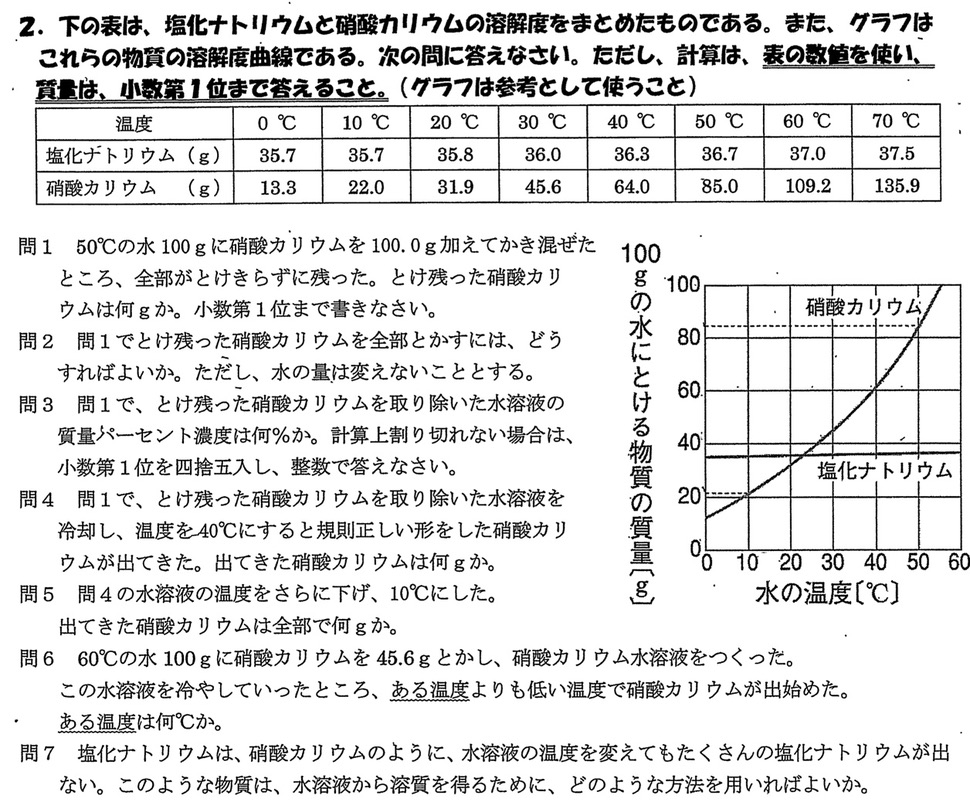
(1)
50℃における硝酸カリウムの溶解度は、表より85.0gなので、100gの水に硝酸カリウムを100.0g加えると、15.0gのとけ残りが発生します。
(2)
表より、硝酸カリウムの溶解度は温度が高いほど高くなると言えるので、水溶液の温度を60℃に上げることで、すべてとけます。
※石灰水は水酸化カルシウムの水溶液ですが、水酸化カルシウムは温度が上がると溶解度が下がります。
(3)
水溶液の質量は100.0g+85.0g=185.0g、溶質である硝酸カリウムの質量は85.0gより、質量パーセント濃度=85.0/185.0×100=45.945・・・≒46.0%
(4)
40℃における硝酸カリウムの溶解度は64.0gより、85.0g-64.0g=21.0gの硝酸カリウムの結晶が析出します。
(5)
10℃における硝酸カリウムの溶解度は22.0gより、85.0g-22.0g=63.0gの硝酸カリウムの結晶が析出します。
(6)
60℃における硝酸カリウムの溶解度は109.2gより、45.6gの硝酸カリウムは100gの水に全て溶けます。
30℃における硝酸カリウムの溶解度は45.6gより、水溶液の温度を30℃より低くすると結晶が析出し始めます。
(7)
塩化ナトリウムは温度を下げても溶解度があまり変化しないので、再結晶として冷やす方法は適さず、水溶液を蒸発させて結晶を得る方法を用います。
スポンサーリンク
第3問

(1)
答:枝つきフラスコ(解説略)
(2)
答:気体の温度(解説略)
(3)
答:沸騰石(解説略)
(4)
純粋なエタノールの沸点は78.3℃、水の沸点は100℃より、試験管1の液体は、エタノールを多く含む混合物です。
(5)
試験管1の液体はエタノールを多く含む混合物より、火を近づけると燃えます。
試験管3の液体は、蒸気の温度が純粋な水の沸点に近いので、水を多く含む混合物と言え、火を近づけても燃えません。
(6)
(4)と(5)の解説参照。
(7)
エタノールの沸点は水の沸点より低いので、混合物を加熱すると、エタノールが先に気体として出てきます。
(8)
答:蒸留(解説略)
第4問

(1)
ア:融点、イ:沸点(解説略)
(2)(3)(4)
物質Xは最初固体であったので、Aは固体、Bは固体+液体、Cは液体の状態です。
ゆえに、加熱開始から10分後に、物質Xは全て液体の状態となります。
(5)
物質Xの融点はBより約60℃なので、表からパルチミン酸です。