第1問

(1)(2)
純水の融点は0℃、沸点は100℃です。
Aの融点では、固体と液体が併存しており、Bの温度が上昇しているときは液体のみの状態です。
(3)(4)
ウからエは純水の沸点で、液体と気体が併存しています。
第2問
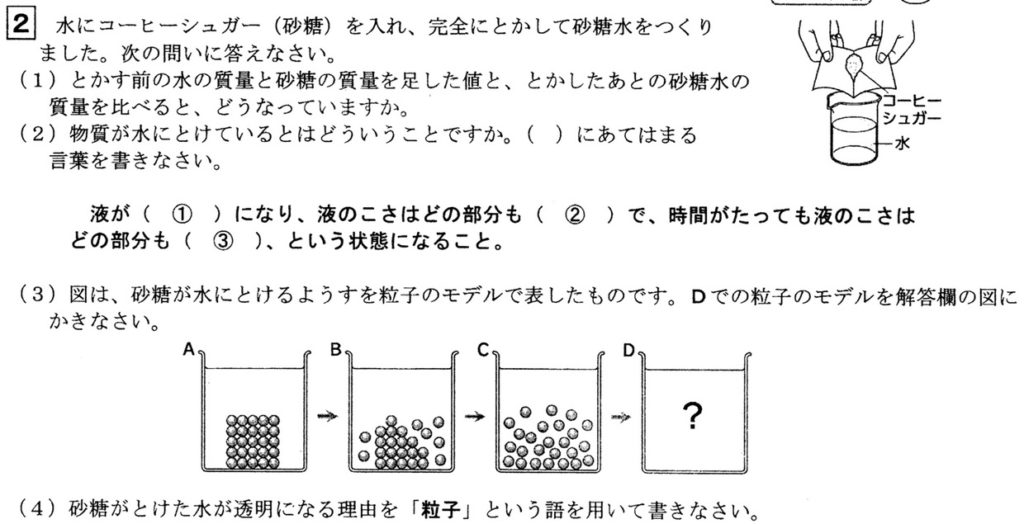
(1)
水の粒子と砂糖の粒子の数がどちらも同じなので、溶かす前と後で質量は同じです。
(2)(3)(4)
物質が水にとけると水溶液になります。
水溶液は、無色透明(有色でもよい)で、どの部分を取っても濃さが均一です。
具体的には、溶質(溶けるもの)を水(溶媒:溶かすもの)に入れると、固体の粒子は水の粒子に衝突しながら拡散するため、かき混ぜなくても溶けていきます。
また水溶液中では、固体の粒子が均一に拡散し、どの部分を取っても濃さ(質量パーセント濃度)が均一です。
溶質が砂糖のとき、水溶液中を拡散する砂糖の粒子は非常に小さいため、無色透明に見えます。
スポンサーリンク
第3問

(1)
塩化ナトリウムは温度が変化しても溶解度があまり変化しない物質で、再結晶の方法として水溶液を蒸発させる方法をとります。
(2)
グラフより、50℃における硝酸カリウムの溶解度は約85gと読めます。
(3)
グラフより、10℃における物質の溶解度が30gより大きいのは、塩化ナトリウムです。
(4)
50℃における硝酸カリウムの溶解度は約85gより、70gの硝酸カリウムは100gの水に全てとけます。
20℃における硝酸カリウムの溶解度は約30gより、硝酸カリウムの結晶が40g(70g – 30g)析出します。
(5)
グラフより、20℃における物質の溶解度が30gより明らかに小さいのは、ミョウバンです。
ミョウバンの結晶は、無色・正八面体状のかたちです。
第4問

炭酸アンモニウムを加熱すると熱分解が起こり、気体としてアンモニアと二酸化炭素が発生します。
二酸化炭素は水に少しとける程度ですが、アンモニアは水に非常によく溶ける(20℃の水1cm3に702cm3溶ける)ため、アンモニアが先に水に溶け、次に二酸化炭素が水に溶けます。
二酸化炭素が水に溶けた水溶液は酸性、アンモニアが水に溶けた水溶液はアルカリ性を示します。
これより、1本目の試験管の水溶液はアルカリ性で、BTB溶液の色は青色に変化し、2本目の水溶液は酸性で、BTB溶液の色は黄色に変化します。
この現象は、気体である二酸化炭素とアンモニアの水への溶けやすさのちがいによって発生します。