山梨県公立高校入試オススメ過去問題集
★過去問

★模擬テスト
※模擬テストは1教科のみ表示。Amazonなどでは5教科すべて販売されています。
大問1 血液成分と血液循環
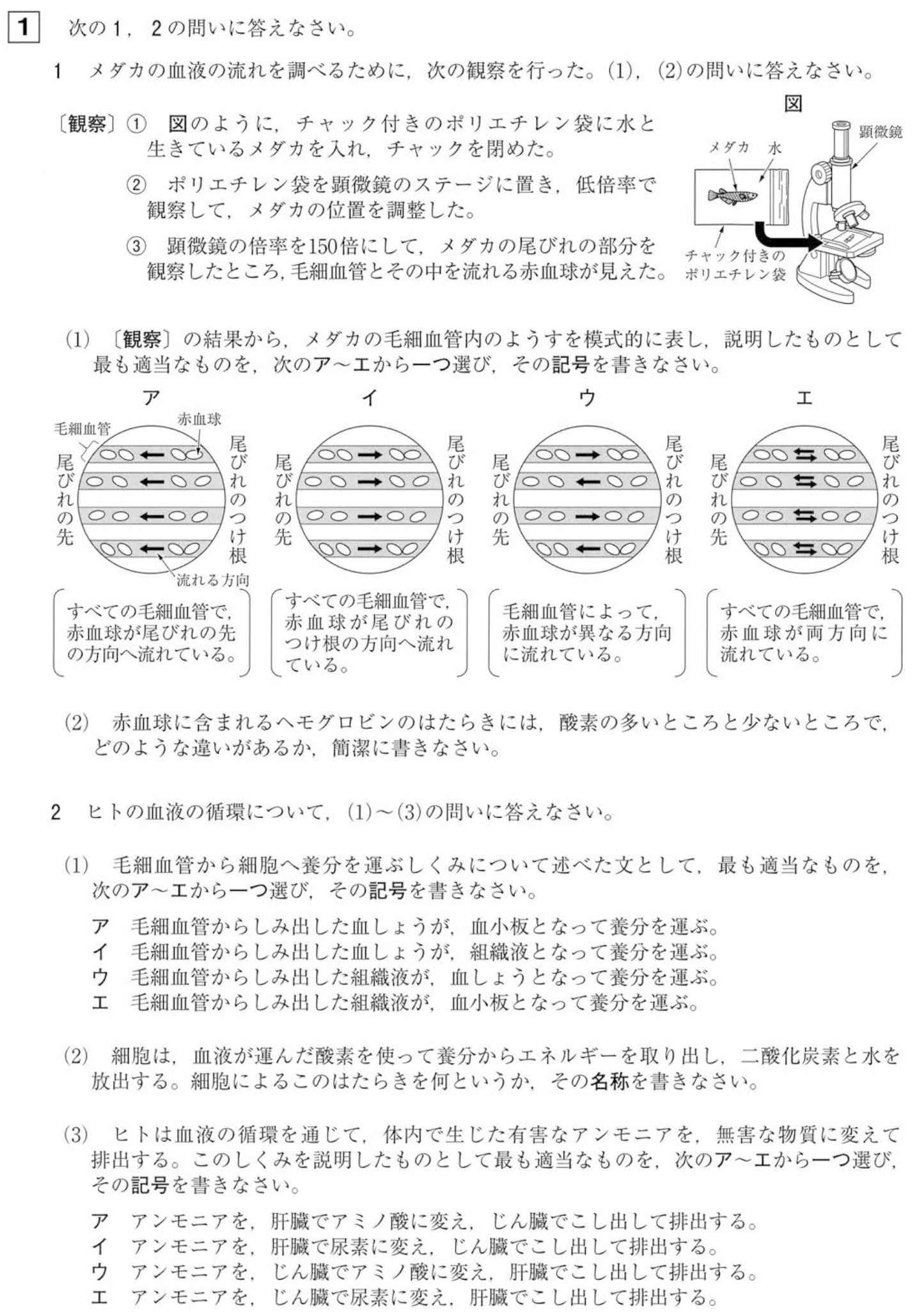
1(1)
解答:ウ
解説:
血液は全身を循環しており、毛細血管によって血液の流れる方向は異なります。
1(2)
解答:(例)酸素が多いところでは、酸素と結びつき、酸素が少ないところでは、酸素を離すはたらき
解説:
解答の通りです。重要事項ですので、必ず暗記してください。
2(1)
解答:イ
解説:
解答の通りです。重要事項ですので、必ず暗記してください。
2(2)
解答:呼吸
解説:
呼吸のメカニズムは、以下のとおりです。
養分+酸素→二酸化炭素+水+アンモニアなどの不要物
呼吸では、養分を燃やすことで、生命活動に必要なエネルギーを得ます。
2(3)
解答:イ
解説:
解答の通りです。重要事項ですので、必ず暗記してください。
スポンサーリンク
大問2 台風
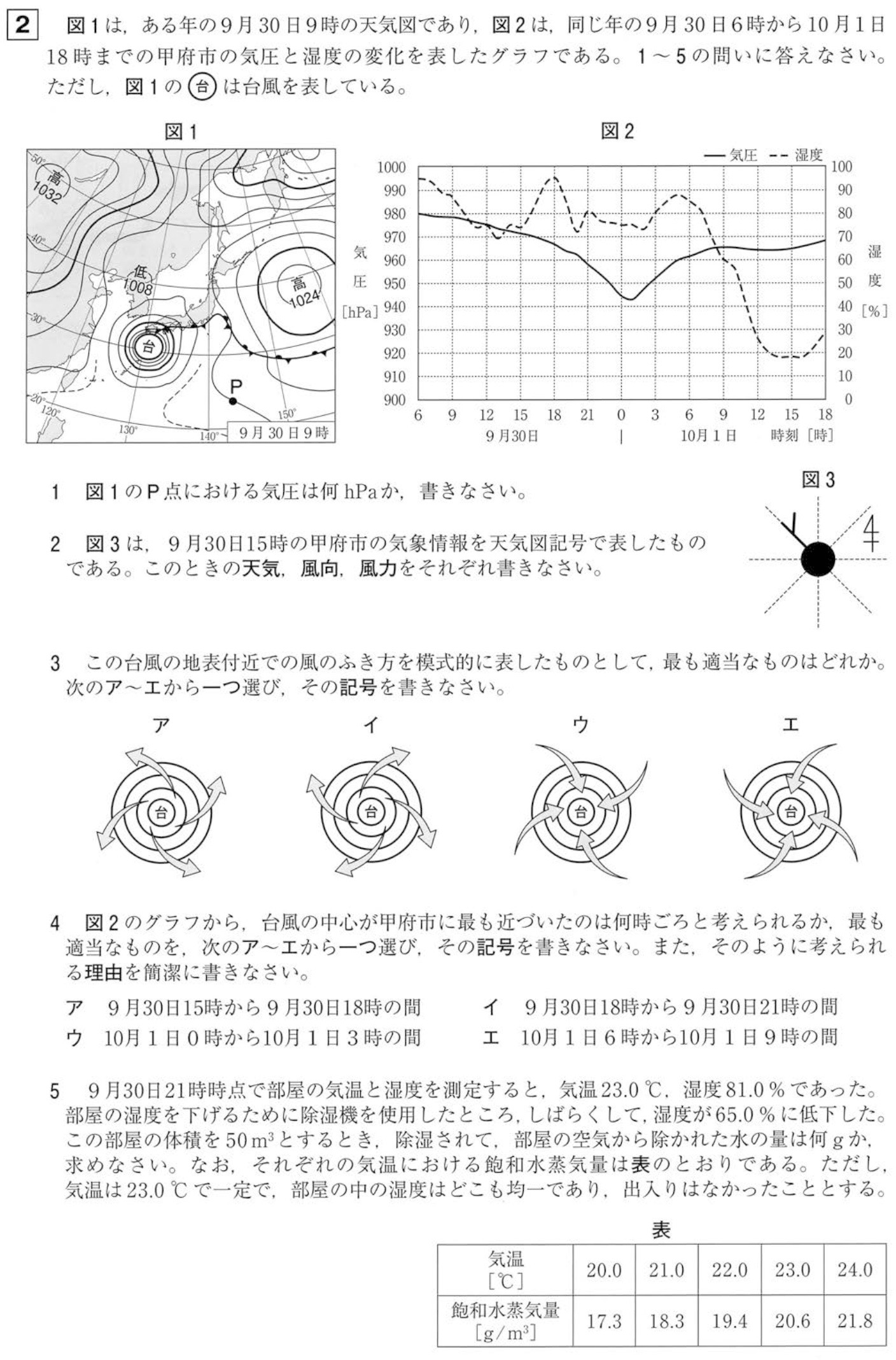
1
解答:1012hPa
解説:
高気圧は中心部へいくほど気圧が高くなること、等圧線は4hPaごとに細い線を引き、20hPaごとに太線を引きます。
よって、P点の気圧は
1024hPa – 4hPa×3=1012hPa
2
解答:天気・・・雨、風向・・・北西、風力・・・1
解説:
解答の通りです。
風力1は、矢羽根の先端から少し離した位置に書くことに注意してください。
3
解答:エ
解説:
台風は低気圧なので、反時計回りに風が吹き込みます。
4
解答:記号・・・ウ、理由・・・(例)10月1日1時ごろの気圧が一番低いから
解説:
台風は低気圧です。低気圧は中心部へいくほど気圧が低くなるので、図2で気圧が最も低い0時頃に台風が通過したと考えられます。
5
解答:164.8g
解説:
除湿された水蒸気の1m3あたりの質量は、
20.6g/m3×0.81 – 20.6g/m3×0.65=20.6g/m3×0.16
50m3では、
20.6g/m3×0.16×50m3=20.6×8g=164.8g
スポンサーリンク
大問3 気体の性質

1
解答:(例)水に溶けやすく、空気より軽い性質
解説:
実験2より、気体Aが水に溶けるとアルカリ性の性質を示すことから、気体Aはアンモニアです。
アンモニアは空気より軽く水に非常にとけやすい気体であるので、上方置換法で捕集します。
2
解答:ア
解説:
問1と実験1より、気体Eは塩化水素です。
塩化水素が水に溶けた水溶液は塩酸(HCl)です。
電離式は、HCl→H+ + Cl–
これより、塩酸を電気分解すると、陽極で塩素が発生します。
塩素には漂白作用や殺菌作用がありますが、本問では水の色が変化した原因が問われているので、選択肢アが正解です。
3
解答:N2
解説:
問1と問2より、気体Bは水素、窒素、二酸化炭素のいずれかです。
実験4より、気体Cは二酸化炭素です。
実験5より、気体Dは水素です。
よって、気体Bは窒素です。
4
解答:イ、エ
解説:
気体Cは二酸化炭素です。
ア:水素のはなしをしています。
イ:正しい。二酸化炭素が固体になったドライアイスは昇華する性質があります。
ウ:窒素のはなしをしています。
エ:正しい。
5
解答:
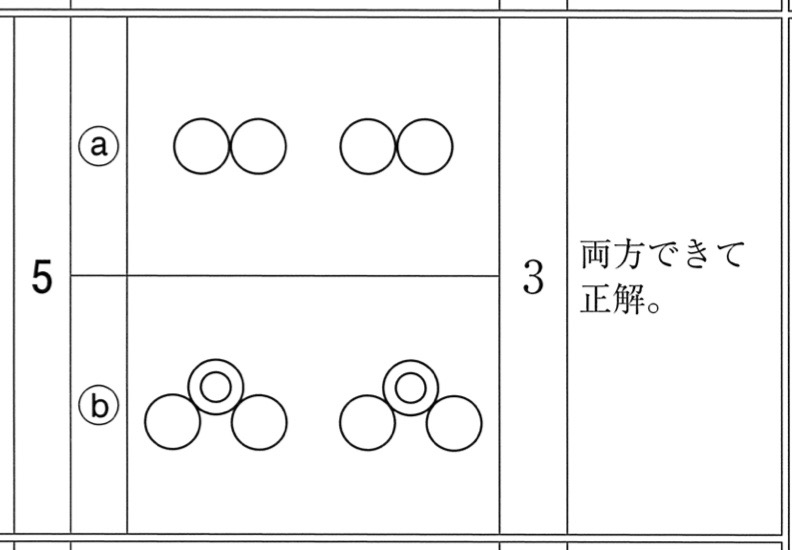
解説:
気体Dは水素です。
燃焼とは酸化すること、つまり酸素と化合することなので、化学反応式は、
2H2 + O2 → 2H2O
この化学反応式をもとに考えて、答えが得られます。
大問4 等速直線運動と等加速度運動 ★5がやや難

1
解答:
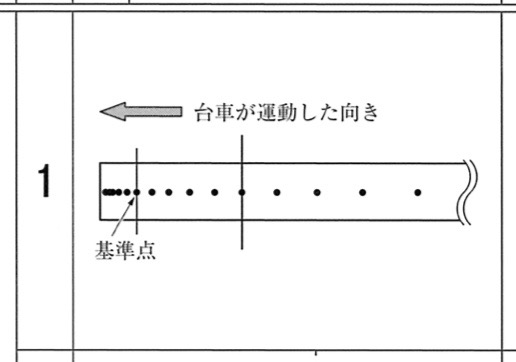
解説:
この記録タイマーは1秒で50打点するので、0.1秒で5打点します。
5打点の数え方は、基準点を0打点と見て数えていきます。
2
解答:130、単位・・・cm/s
解説:
図2の区間CとDはテープ2枚より、0.1s×2=0.2sに相当します。
テープ2枚の長さは、11cm+15cm=26cmより、
平均の速さ[cm/s]=26cm/0.2s=26×5=130cm/s
3
解答:(例)台車の運動の向きに力がはたらいていないから
解説:
運動方向に力が働かないと、等速直線運動(速さが一定である)をします。
運動方向に力が働くと、等加速度運動(速さが一定の割合で変化する)をします。
4
解答:a・・・ア、b・・・イ
解説:
重力は、地球上ではどこでも同じ大きさです。
台車が斜面上にあるとき、台車にはたらく重力(W)は、斜面方向の分力と斜面に垂直方向の分力に分解できます。
これら2つの分力は、重力から分解された力であるので、重力よりも大きさが小さいです。
斜面に垂直方向の分力(台車が斜面を押す力)は、斜面が台車を押し返す力である垂直方向(N)とつり合います。
よって、W>Nです。
重力は地球上ではどこでも同じ大きさであるので、台車にはたらく重力の斜面方向の分力も、図1の斜面上ではどこでも同じ大きさです。
5 ★やや難
解答:ア
解説:
斜面の長さを変えずに傾きを大きくしたことから、台車が斜面を下り始める高さが大きくなります。
力学的エネルギー保存の法則より、台車が水平面を運動する速さは、図1よりも大きくなります。
斜面の傾きを大きくすると、台車にはたらく重力の斜面方向の分力が大きくなるので、速さの増え方が大きくなります。
以上より、答えは選択肢アです。
大問5 生物の進化と分類

1
解答:ウ
解説:
中生代の示準化石として、アンモナイトと恐竜を覚えましょう。
アのフズリナは古生代の示準化石、イのナウマンゾウは新生代の示準化石、エのサンヨウチュウは古生代の示準化石です。
2
解答:b・・・①④、c・・・②③
解説:
始祖鳥のハチュウ類の特徴は、歯とツメと尻尾を見ます。
ホニュウ類の特徴は、毛と口と翼を見ます。
3
解答:記号・・・Y、理由・・・(例)ハチュウ類は変温動物で、グラフYは周囲の気温の変化にともなって体温が変化するようすを示しているから
解説:
ハチュウ類は変温動物なので、外界の温度に合わせて体温を変えることができます。
鳥類は恒温動物なので、外界の温度が変化しても体温を一定に保つことができます。
4
解答:相同器官
解説:
問題文に「現在と形やはたらきが違っていても、もとは同じ器官にあたると考えられるもの」とあるので、相同器官です。
5
解答:イ
解説:
人の腕と相同であるものとして、カエルの前あし、ワニの前あし、スズメのつばさ、コウモリのつばさ、クジラの胸びれ、を覚えましょう。
大問6 火成岩のつくり

1(1)
解答:ウ
解説:
双眼実体顕微鏡は、低倍率の観察に適すること、立体的に見えること、上下左右が同じに見えること、の3つを抑えましょう。
1(2)
解答:エ
解説:
造岩鉱物で白っぽい色をしているもののうち、規則的に割れるのがチョウ石、不規則に割れるのがセキエイです。
黒っぽい色をしているもののうち、規則的に割れるのがクロウンモ、柱状かつ暗緑色であるのがカクセン石です。
1(3)
解答:有色鉱物
解説:
解答の通りです。
2(1)
解答:a・・・イ、b・・・ア
解説:
マグマの二酸化ケイ素の割合が多いと、火山噴出物の色が白っぽくなります。また、粘り気が強くなるので、爆発的噴火を起こします。
マグマの二酸化ケイ素の割合が少ないと、火山噴出物の色が黒っぽくなります。また、粘り気が弱くなるので、穏やかな噴火を起こします。
2(2)
解答:(例)気体が抜け出た
解説:
解答の通りです。
大問7 中和 ★4が難

1
解答:(例)水を蒸発させる
解説:
HCl + NaOH → NaCl + H2O
これより、うすい塩酸に水酸化ナトリウム水溶液を加えると中和が起こり、塩として塩化ナトリウムが生じます。
塩化ナトリウムは温度による溶解度の変化が小さいので、再結晶の方法として、水溶液を蒸発させる方法をとります。
2
解答:エ
解説:
水溶液DのBTB溶液の色が緑色であることから、水溶液Dは中性です。
さらに水酸化ナトリウム水溶液を加えた水溶液E、F、GはOH–が加わっていくので、アルカリ性です。アルカリ性の水溶液ではBTB溶液の色は青色になります。
3
解答:ア
解説:
マグネシウムは塩酸などの酸性の水溶液と反応して、気体として水素が発生します。
酸性が強いほど多くなる、つまり水溶液中のH+の数が多いほど、発生する水素の体積は多くなります。
表では、うすい水酸化ナトリウム水溶液を加えていくほどH+の数が少なくなっていくので、うすい水酸化ナトリウム水溶液を加えていないビーカーAがH+の数が最も多く、水素が最も勢いよく発生すると考えられます。
4 ★難
解答:
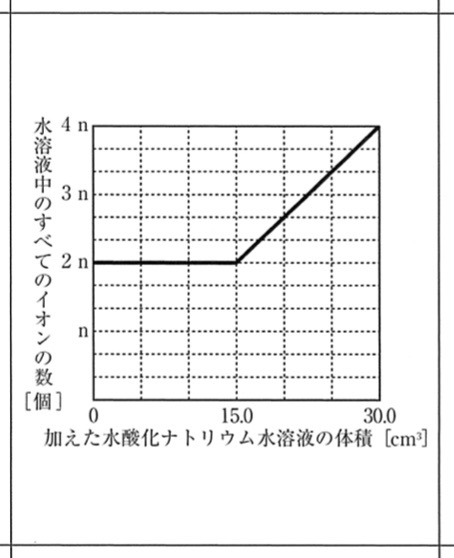
解説:
HCl → H+ + Cl–
NaOH → Na+ + OH–
H+ + OH– → H2O
Na+ + Cl– →NaCl
これより、水酸化ナトリウム水溶液が0cm3のとき、水素イオンと塩化物イオンが同数あるので、水溶液中のすべてのイオン数は2nです。
中和が起こる間、つまり水酸化ナトリウム水溶液が0cm3〜15.0cm3のとき、水溶液中のすべてのイオン数は2nで変化しません。
中和が起こらなくなると、加えた水酸化ナトリウム水溶液のNa+とOH–の分だけ、イオン数が増えていきます。
ビーカーDは中性の水溶液で、うすい塩酸10.0cm3とうすい水酸化ナトリウム水溶液15.0cm3が反応しています。
つまり、うすい水酸化ナトリウム水溶液15.0cm3にOH–がn個あることから、Na+とOH–はn個ずつ計2n個あります。
よって、加えた水酸化ナトリウム水溶液が30.0cm3のとき、水溶液中のすべてのイオン数が15.0cm3からさらに2n個増えます。
Na+とOH–の個数の比は1:1であるので、直線的に増えていきます。
5
解答:20.0cm3
解説:
ビーカーDは中性の水溶液で、うすい塩酸10.0cm3とうすい水酸化ナトリウム水溶液15.0cm3が反応しています。
ビーカーEは水酸化ナトリウム水溶液が5.0cm3、ビーカーFは水酸化ナトリウム水溶液が10.0cm3、ビーカーGは水酸化ナトリウム水溶液が15.0cm3多いです。
合計で、30.0cm3=15.0cm3×2水酸化ナトリウム水溶液を中和すればよいので、うすい塩酸は10.0cm3×2=20.0cm3必要です。
大問8 消費電力 ★1(3)が難

1(1)
解答:12.6Ω
解説:
オームの法則より、
豆電球X1の抵抗=3.8V÷(500×1/1000A)=3800/500=38/5=7.6Ω
豆電球Yの抵抗=3.8V÷(760×1/1000A)=3800/760=380/76=5Ω
直列だから、合成抵抗の大きさは、
7.6Ω+5Ω=12.6Ω
1(2)
解答:1.89A
解説:
豆電球X2の抵抗=豆電球X1の抵抗=7.6Ω
並列回路だから、回路全体の電流の大きさは、
5.7V/7.6Ω+5.7V/5Ω=5.7×12.6/38=57×1.26/38=3×1.26/2=3×0.63=1.89A
1(3) ★難
解答:エ
解説:
消費電力の値ではなく大きさが問われているので、近似値を計算します。
消費電力の大きさが大きいと、豆電球は明るく点灯します。
・実験③
合成抵抗の大きさは12.6Ω、回路全体の電圧の大きさは5.7Vであるので、回路全体の電流の大きさは、5.7/12.6Aです。
豆電球X1の消費電力[W]=(5.7/12.6A)2×7.6Ω≒(1/2)2×7.6=1/4×7.6=1.9W
豆電球Yの消費電力[W]=(5.7/12.6A)2×5Ω≒(1/2)2×5=1/4×5=1.25W
・実験④
豆電球X1の消費電力[W]=(5.7V)2÷7.6Ω=62/8=36/8=4.5W
豆電球Yの消費電力[W]=(5.7V)2÷5Ω=62/5=36/5=7.2W
明らかに実験④の豆電球Yの消費電力が最も大きいので、実験④の豆電球Yが最も明るく点灯します。
2(1)
解答:①・・・光、②・・・熱
解説:
白熱電球はフィラメントが白熱化して、光を発します。
つまり、白熱電球では、電気エネルギーのほとんどが熱エネルギーで、一部が光エネルギーになります。
LEDは電気エネルギーは直接光エネルギーに変換されるので、同じ明るさにするのに必要な電気エネルギーが、白熱電球より少なくなります。
2(2)1
解答:19%
解説:
数学の文章題です。
60Wの白熱電球4個の消費電力+40Wの白熱電球8個の消費電力=60W×4+40W×8=240+320=560W
10.6WのLED4個の消費電力+8.0WのLED8個の消費電力=10.6W×4+8.0W×8=42.4+64=106.4W
(106.4W/560W/×100=10640/560=1064/56=266/14=133/7=19%




