宮城県公立高校入試オススメ過去問題集
★過去問

★模擬テストとリスニング対策

※模擬テストは1教科のみ表示。Amazonなどでは5教科すべて販売されています。
第一問 1 血液循環
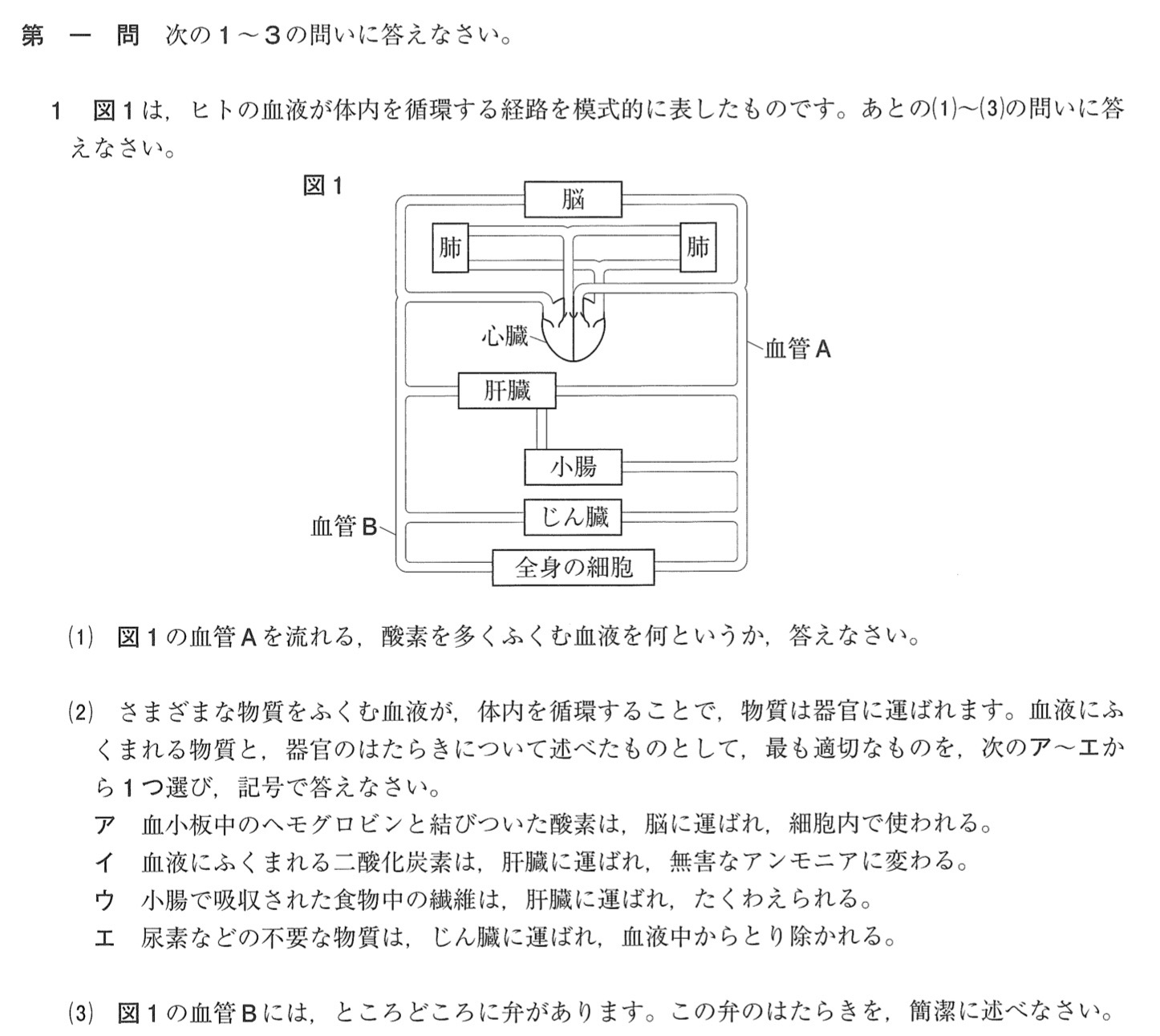
(1)
解答:動脈血
解説:
血管Aは大動脈で、肺でガス交換した後の血液が流れているので、血管Aには動脈血が流れています。
(2)
解答:エ
解説:
ア:血小板ではなく赤血球です。
イ:細胞呼吸でアミノ酸が分解され、有害なアンモニアが生じます。アンモニアは肝臓に運ばれ、無害な尿素に変わります。
ウ:ブドウ糖は小腸の柔毛で吸収され、門脈を通って肝臓へ行き、一部がグリコーゲンとして蓄えられます。
エ:正しい。
(3)
解答:(例)血液の逆流を防いでいる。
解説:
血管Bは大静脈で、血液の逆流を防ぐ弁があります。
第一問 2 マグマと火山の噴火

(1)
解答:火山岩
解説:
玄武岩は、マグマが地表や地表付近で急に冷やされてできた火山岩です。
(2)
解答:ウ
解説:
玄武岩は火山岩なので、鉱物は角張っています。また、玄武岩は閃緑岩など黒っぽい鉱物が多く含まれています。
(3)
解答:①・・・ア、②・・・エ
解説:
(2)より、伊豆大島には玄武岩(黒っぽい)が広く分布していることから、マグマには二酸化ケイ素があまり多く含まれていないので、マグマの粘りけは弱いです。
「佐藤さんが示したハザードマップの一部」を見ると、火山灰は北東に広がっていることから、伊豆大島の上空には南西の風が吹くと言えます。
第一問 3 ダニエル電池

(1)
解答:溶質
解説:
とかすものが溶媒、とけているものが溶質です。
(2)
解答:直流
解説:
単純な知識問題なので、解説略。
(3)
解答:イ
解説:
イオン化傾向がZn>Cuより、亜鉛が-極で銅が+極です。
電流は+の電気より、電流は銅板から亜鉛板に流れます。
(4)
解答:ウ
解説:
ダニエル電池は化学電池なので、物質の化学エネルギーが電気エネルギーに移り変わることで、電気を得ます。
(5)
解答:0.025A
解説:
オームの法則より、
V=IR ⇔ I=V/R=1.0V/40Ω=0.025A
(6)
解答:エ
解説:
イオン化傾向がZn>Cuより、亜鉛がとけて電子を2個放出し、電子は銅板へ移動します。
銅板へ移動した電子2個を、硫酸銅水溶液中の銅イオンが受け取り銅が生じます。
スポンサーリンク
第二問 光合成

1
解答:葉緑体
解説:
単純な知識問題なので、解説略。
2
解答:エ
解説:
「[調べ方]」で用いたBTB液は、酸性・中性・アルカリ性を調べる試薬です。
ゆえに、二酸化炭素の性質の一つ、水に溶けると水素イオンが生じて水溶液は酸性を示す、ことを利用します。
3
解答:ウ
解説:
「仮説」より、光合成量と呼吸量がつり合う、光補償点の状態であることが分かります。ゆえに試験管AのBTB液の色は、緑色のままです。
試験管Bは光が当たっていないので、オオカナダモは呼吸のみを行うため、BTB液の色は緑色→黄色になります。
4
解答:①・・・ア、②・・・ウ、③・・・カ
解説:
表から、試験管AのBTB溶液の色が緑色→青色に変化したことから、光合成が呼吸よりも盛んに行われ、液中の二酸化炭素が消費されて青色に戻ったことが分かります。
試験管BのBTB液の色が緑色→黄色に変化したのは、光が当たっていないので、オオカナダモは光合成を行わず呼吸のみを行う(二酸化炭素を放出する)ためと考えられます。
5
解答:条件・・・(例)オオカナダモを入れない。、観察結果・・・(例)緑色から変化しない。
解説:
試験管Aの条件:オオカナダモ+光+水(BTB液)→BTB液は緑色から青色、です。
しかし、これだけだと試験管AのBTB溶液の色が変化したのは、光が当たったためであるとも言えるので、オオカナダモのみを入れない試験管Cを用意します。
試験管Cの条件:光+水(BTB液)→BTB液は緑色のままと期待される
以上のより、答えが得られます。
スポンサーリンク
第三問 太陽の動き

1
解答:天球
解説:
単純な知識問題なので、解説略。
2
解答:①・・・ア、②・・・ウ
解説:
地球は地軸の北極側から見て西から東へ(反時計回り)1日360°一定の速度で自転するため、太陽や星は1日で東から西へ一定の速度で動いて見えます。
太陽の南中時刻は、東経135°の兵庫県明石市に太陽が真南の空に位置した(南中した)ときの時刻を正午(12時)としています。
太陽は1日(24時間)で360°、つまり1°につき4分かけて東から西へ動いて見えるので、兵庫県赤石市より東の位置にある場所では、12時より前に太陽は南中します。
3
解答:イ
解説:
8.7cm÷2.3cm/h=87/23h=3h+19/23h≒3h+0.8h=3時間48分
A点は8時より、日の出の時刻として最も適切なのは、選択肢イです。
4(1)
解答:エ
解説:
図2より、夏至→秋分の太陽の通り道の変化を見ると、南中高度が低くなり、日の出の位置は南に移動していることが分かります。
4(2)
解答:イ
解説:
図2の太陽の通り道の角度は90°-緯度なので、太陽の通り道の角度は変化せず、元の太陽の通り道の線と平行になります。
夏至の日の太陽の南中高度=90°-緯度-23.4°、より、地軸の傾きが23.4°から22°に1.4°小さくなったら、太陽の南中高度も1.4°低くなります。つまり、元の太陽の通り道に対して、わずかに南へ平行線を書けばよいので、答えは選択肢イです。
第四問 ばねを用いた力のつり合い ★5が難


1
解答:イ
解説:
弾性力のはなしをしている選択肢を探します。
ア:重力と垂直抗力のつり合いのはなしをしています。
イ:正しい。
ウ:重力による速さが一定の割合で増えていく、等加速度運動のはなしをしています。
エ:摩擦力のはなしをしています。
2
解答:1.2cm
解説:
ばねに加わる力の大きさが2.5Nのとき、ばねののびが1.0cmであることから、フックの法則より、
3N×(1.0cm/2.5N)=3/2.5cm=30/25=6/5=1.2cm
3
解答:
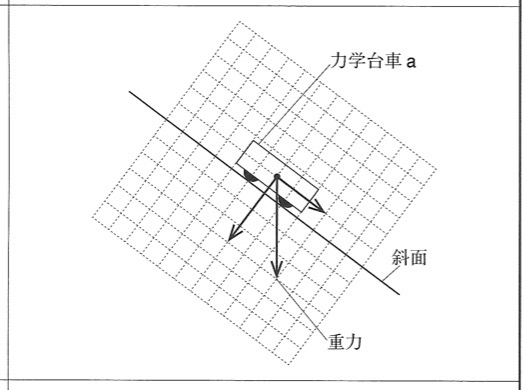
解説:
直角三角形を書く要領で、重力の斜面方向の分力と、重力の斜面に垂直方向の分力を作図します。
4
解答:ウ
解説:
重力の斜面方向の分力=重力×(高さ/斜辺)
図3と図4は2辺の長さが同じ3:4:5の直角三角形を用いているので、高さ/斜辺も同じで、重力のみ異なります。
重力[N]=物体の質量[g]×1N/100gなので、重力の大きさは物体の質量で決まります。
力学台車aの質量は500g、力学台車bの質量は1000gで、力学台車bの質量は力学台車aの質量の2倍であることから、重力も2倍で、斜面方向の分力の大きさも2倍です。
5 ★難
解答:4.8cm
解説:
力学台車aに固定するおもりの個数をa個、力学台車bに固定するおもりの個数をb個とします。
■力学台車a
力学台車aの重力の斜面方向の分力[N]=(500+100a)[g]×1N/100g×3/5
図2より、ばねAにおいて1cm/Nが成り立つので、
ばねAののび=(500+100a)×1/100×3/5[N]×1cm/N=(500+100a)×1/100×3/5[cm]
■力学台車b
力学台車bの重力の斜面方向の分力[N]=(1000+200b)[g]×1N/100g×3/5
図2より、ばねBにおいて1cm/2.5N=1/2.5[cm/N]が成り立つので、
ばねBののび=(1000+200b)×1/100×3/5[N]×1/2.5[cm/N]=(1000+200b)×1/100×3/5×1/2.5[cm]
■おもりの個数を求める
ばねAののび:ばねBののび=1:1、より
(500+100a)×1/100×3/5:(1000+200b)×1/100×3/5×1/2.5=1:1
⇔ 500+100a:(1000+200b)×1/2.5=1:1
⇔ 500+100a=(1000+200b)×1/2.5
⇔ 1250+250a=1000+200b
⇔ 200b=250+250a=250(1+a)
⇔ 4b=5(1+a)
ばねAとBののびが最も小さいので、おもりの個数aとbがなるべく小さくなるよう上式を考えます。
a、bは自然数、4と5は互いに素だから、bは5の倍数の最小の自然数です。よって、b=5、a=3です。
■ばねAとBののび
力学台車aと100gのおもり3個の質量=500g+300g=800g
重力の大きさ=8N
力学台車aと100gのおもり3個の重力の斜面方向の分力[N]=8N×3/5=1.6×3=4.8N
ばねAののび=4.8N×1cm/N=4.8cm=ばねBののび
第五問 硫酸バリウムの定量 ★5がやや難

1
解答:イ
解説:
化合物を選びます。
ア:H2より、単体です。
イ:正しい。
ウ:Sより、単体です。
エ:Mgより、単体です。
2
解答:HCl
解説:
塩化バリウムと硫酸が反応すると、塩化水素と硫酸バリウムが生じます。
BaCl2+H2SO4→HCl+BaSO4
Cl原子の個数が左辺2個で右辺1個なので、HClを2倍します。
BaCl2+H2SO4→2HCl+BaSO4
他の原子および原子団の個数は、左辺と右辺で等しいので、化学反応式は上式となります。
3
解答:
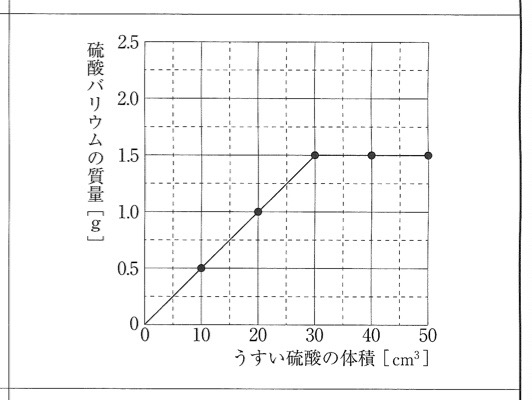
解説:
表をもとにグラフを書くだけです。
4
解答:(例)ビーカーC、D、Eに入っている塩化バリウムが、すべて硫酸と反応したから。
解説:
化学反応式の計算問題では、限られた量は何かを調べることが重要です。
この実験では、うすい塩化バリウムが50.0cm3と一定なので、表より、うすい硫酸の体積を増やしていくと、硫酸バリウムの質量が1.5gと一定になることが分かります。
つまり、表より、うすい塩化バリウム50.0cm3とうすい硫酸30.0cm3が過不足無くすべて反応すると、硫酸バリウムが1.5g生じます。
5 ★やや難
解答:1.25g
解説:
うすい塩化バリウム50.0cm3とうすい硫酸30.0cm3が過不足無くすべて反応すると、硫酸バリウムが1.5g生じます。
体積比は、
うすい塩化バリウム:うすい硫酸=50.0cm3:30.0cm3=5:3=45.0cm3:27.0cm3
これより、うすい塩化バリウム45.0cm3と完全に反応するには、うすい硫酸27.0cm3が必要であるので、うすい硫酸25.0cm3ではうすい塩化バリウムはすべて反応しません。
しかし、うすい硫酸25.0cm3はすべて反応することが分かります。
うすい塩化バリウム50.0cm3とうすい硫酸30.0cm3が過不足無くすべて反応すると、硫酸バリウムが1.5g生じるので、うすい硫酸25.0cm3がすべて反応したときに生じる硫酸バリウムの質量を、比例式を立てて計算します。
30.0cm3:1.5g=25.0cm3:x
x=1.5×25/30=1.5×5/6=5/4=1.25g






