
👉教師紹介・料金
※授業料1回1,500円+交通費(コミコミ最大3,000円)・入会金なし・お好きな日時に受講・3回のお試し期間あり(無料教材あり)
☆学力テストはこれで完璧!オリジナル教材☆
👉北海道学力テストはこれで完璧!オリジナル教材+過去問一覧
※過去問の販売はできませんのでご注意ください。
中学1年北海道学力テスト第2回「理科」(2022年)問題・解答・解説
大問1 白い粉末の分類

問1
解答:二酸化炭素
解説:
火がついたことから、有機物であることが分かります。
有機物が燃える(=酸化する=酸素原子と化合する)と、水と二酸化炭素が発生します。
二酸化炭素が石灰水(水酸化カルシウム)に溶けると中和が起こり、塩として水に溶けにくい白色の個体である炭酸カルシウムが生じて、石灰水が白くにごります。
問2
解答:有機物・・・B、C、無機物・・・A、共通に含まれるもの・・・炭素
解説:
実験②より、白い粉末Bはかたくり粉(デンプン)です。デンプンは有機物です。
実験③より、白い粉末Aは食塩です。食塩(塩化ナトリウム)は無機物です。
消去法で、白い粉末Cは砂糖です。砂糖は有機物です。
有機物が燃える(O原子と化合する)と水(H2O)と二酸化炭素(CO2)が発生することから、共通に含まれるものは炭素原子(C)と水素原子(H)原子です。
問3
解答:A・・・食塩、B・・・かたくり粉、C・・・砂糖
解説:
問2解説参照。
問4
解答:イ、ウ
解説:
ア:無機物のうちの非金属です。
イ:有機物です。
ウ:有機物です。
エ:無機物のうちの金属です。
大問2 密度

問1
解答:記号・・・B、密度・・・3.5g/cm3
解説:
密度の単位[g/cm3]より、原点を通るグラフの傾きが最も大きいとき、密度が最も大きくなります。
グラフより、物質Aの傾き(密度)は2g/1cm3=2g/cm3、物質Bの傾き(密度)は7g/2cm3=3.5g/cm3より、密度が最も大きいのは物質Bです。
問2
解答:AとC
解説:
密度の単位[g/cm3]より、原点を通るグラフ上にある2点は原点からの傾きが等しいので、密度が等しいです。同一物質では密度が等しいです。
グラフより、物質Aの傾き(密度)は2g/1cm3=8g/4cm3より、物質Aと物質Cの密度は等しいことから、同じ物質からできていると考えられます。
問3
解答:記号・・・D、E、理由・・・水の密度より小さいから。
解説:
固体や液体は、密度が大きい液体に浮きます。
本問では水の密度を1.0g/cm3としているので、グラフの傾きが1より小さい物質は水の密度より小さくなるので、水に浮きます。
原点を通り傾きが1のグラフを書いて、そのグラフより下側にある物質DとEは傾き(密度)が1より小さいので、水に浮きます。
問4
解答:15.0cm3
解説:
単位に注意して計算すると、
40.5g÷2.7g/cm3=405/27=45/3=15.0cm3
大問3 溶解度
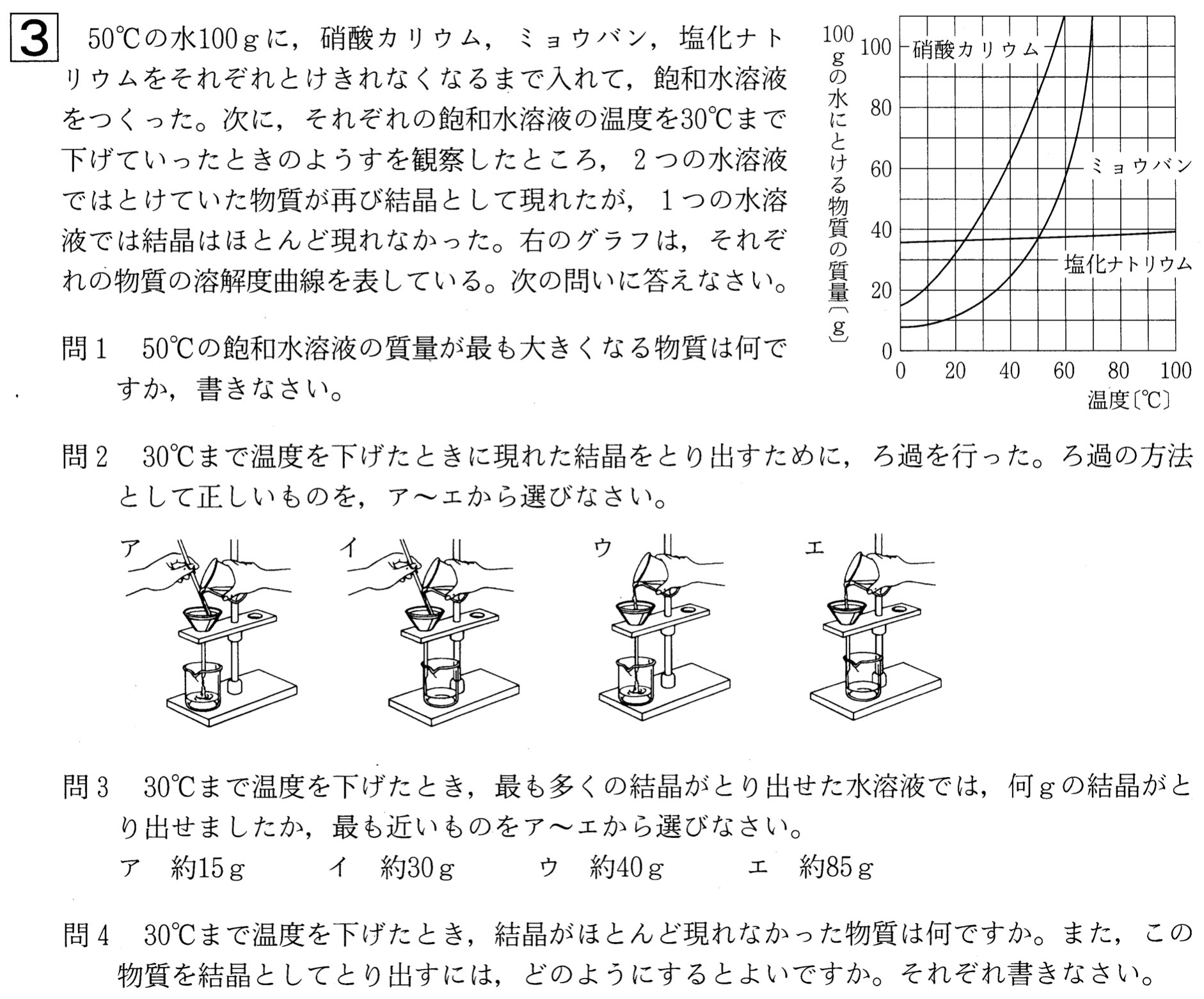
問1
解答:硝酸カリウム
解説:
与えられた溶解度曲線において、飽和水溶液中に含まれる水の質量は100gなので、50℃における溶解度が最も大きい物質を選べばよいです。
グラフより、50℃における溶解度が最も大きいのは、硝酸カリウムです。
問2
解答:イ
解説:
ろ過の手順は、①液をガラス棒につける、②ガラス棒の先をろ紙の三重部分につける、③ろうとのとがった部分をビーカーにつける、です。
問3
解答:ウ
解説:
グラフを用いて、温度を50℃→30℃まで下げたときの溶解度の減少が最も大きい物質を選べばよいので、最も多くの結晶が取り出せた水溶液は硝酸カリウム水溶液です。
グラフより、硝酸カリウムの50℃における溶解度は約85g、30℃における溶解度は約45gより、取り出せた結晶の質量は、約40gです。
問4
解答:物質・・・塩化ナトリウム、取り出す方法・・・水を蒸発させる。
解説:
グラフより、塩化ナトリウムは温度を下げても溶解度があまり変化しないので、水溶液を冷やしても結晶はほとんど現れません。
このような物質を取り出すには、水溶液を蒸発させる方法を取ります。
大問4 酸素の捕集

問1
解答:水上置換法
解説:
単純な知識問題なので、解説略。
問2
解答:水にとけにくい気体
解説:
単純な知識問題なので、解説略。
問3
解答:はじめは装置の中にあった空気が出てくるから。
解説:
単純な知識問題なので、解説略。
問4
解答:気体・・・酸素、液体X・・・うすい過酸化水素水
解説:
二酸化マンガンにうすい過酸化水素水を通すと、気体として酸素が発生します。
二酸化マンガンは、化学変化によって他の物質に変化せず、反応を促進するのを助けるはたらきをするだけ(参考:触媒作用)なので、二酸化マンガンの質量のみを増やしても、酸素の発生量は変わりません。
大問5 アンモニアの捕集

問1
解答:手であおぐようにしてかぐ。
解説:
単純な知識問題なので、解説略。
問2
解答:加熱すること。
解説:
中学範囲のアンモニアの発生法として、塩化アンモニウムと水酸化カルシウムを混ぜて加熱する方法があります。
この反応は加熱を続けないと反応が進まない(吸熱反応)です。
しかし、塩化アンモニウムと水酸化ナトリウムの反応は発熱反応なので、反応が始まると加熱を止めても反応が進みます。
問3
解答:水に非常にとけやすい性質。
解説:
アンモニアは水に非常にとけやすい気体(参考:1cm3のアンモニアに20℃の水702cm3がとける)なので、スポイトで水を加えると丸底フラスコ内のアンモニアが水に急激に溶けこみます。
丸底フラスコ内の気圧が急激に下がり、ビーカーのフェノールフタレイン溶液を含む水が吸い上げられ、赤色の噴水となります。
アンモニアが水にとけると、アルカリ性の水溶液であるアンモニア水となるため、フェノールフタレイン溶液は透明から赤色に変化します。
問4
解答:薬品X・・・フェノールフタレイン溶液、何性・・・アルカリ性
解説:
問3解説参照。
大問6 水溶液の性質と濃度

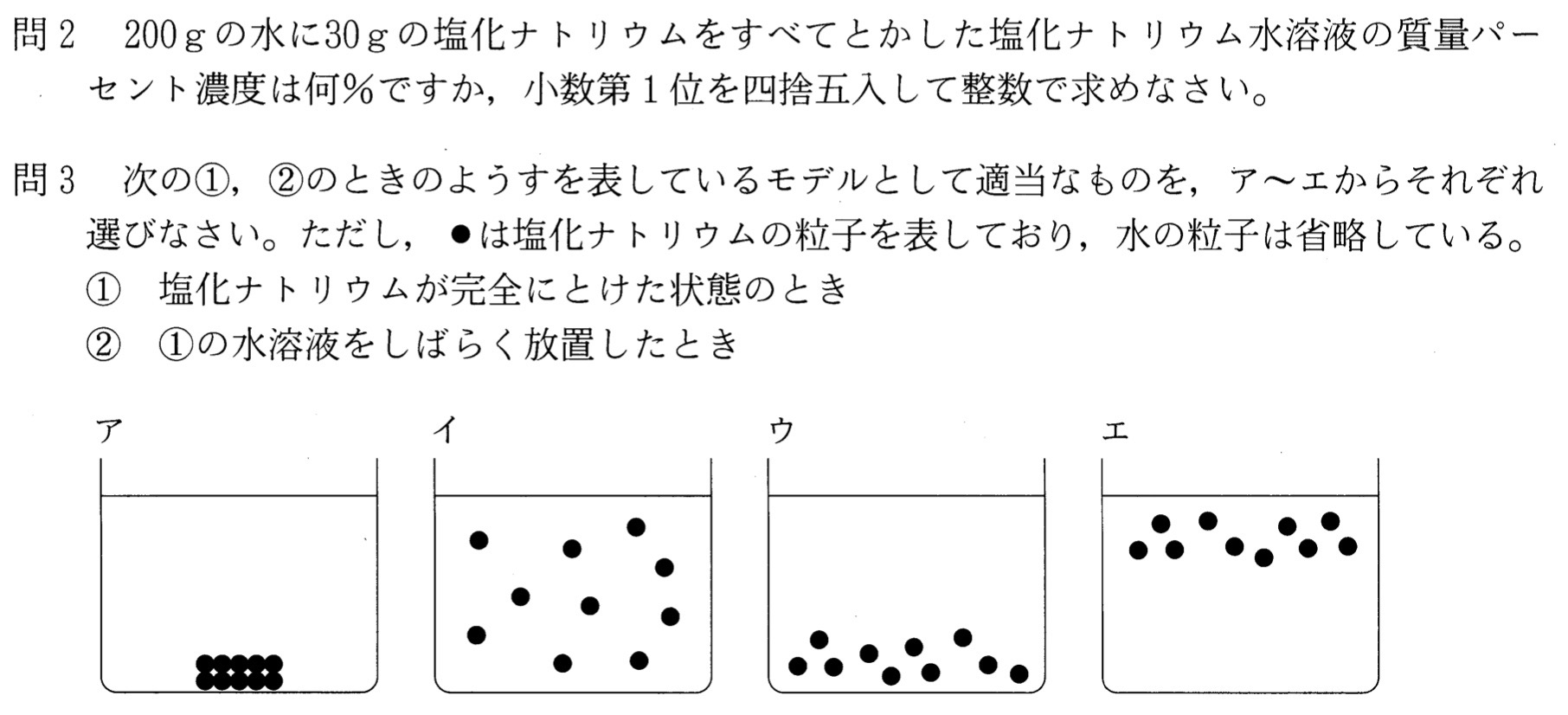
問1
解答:溶媒
解説:
単純な知識問題なので、解説略。
問2
解答:13%
解説:
質量パーセント濃度は、水と水にとけた溶質の質量のみを考えます。
質量パーセント濃度=30g÷(30g+200g)×100=3/23×100=300/23=13.04・・・≒13%
問3
解答:①・・・イ、②・・・イ
解説:
水をつくる水分子は、水中でランダムに動いています。
物質が水にとけるとき、物質をつくる粒子が水分子と衝突するため、かき混ぜなくても粒子は均一に拡散していきます。その水溶液を放置しても、状態は変わりません。
大問7 混合物の蒸留
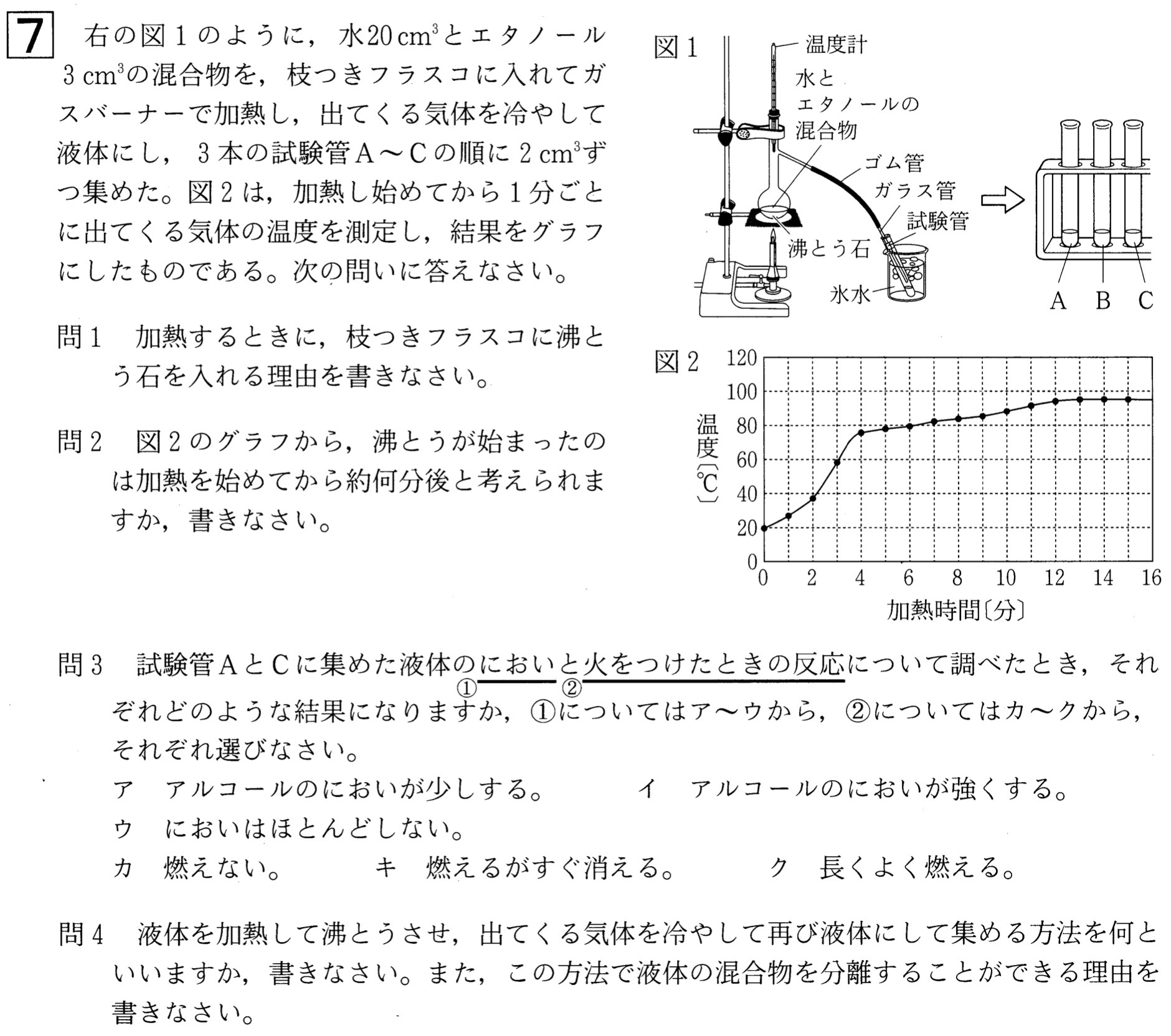
問1
解答:急に沸とうするのを防ぐため。
解説:
単純な知識問題なので、解説略。
問2
解答:約4分後
解説:
液体が沸点に達したとき、液体に加えられた熱は液体を水蒸気にするのに使われるため、温度は上昇しません。この温度が一定となるときの温度を沸点といいます。
よって図2において、沸騰が始まったのは約4分後です。このときの沸点は約78℃とエタノール沸点と同じなので、エタノールの沸騰が起こったと考えられます。
問3
解答:①A・・・イ、①C・・・ウ、②A・・・ク、②C・・・カ
解説:
試験管に集まる液体は、混合液が沸騰して生じた気体が冷えてできたものです。
問1の考察より、図2ではエタノールが先に沸騰して気体になっています。
試験管Aは加熱を始めてから最初に集めた液体なので、エタノールを多く含む液体が集まっています。よって、アルコールのにおいが強くして(イ)、火をつけたら長くよく燃えます(ク)。
試験管Cは加熱を始めてから最後に集めた液体なので、水を多く含む液体が集まっています。よって、アルコールのにおいがほとんどせず(ウ)、火をつけたら燃えない(カ)と考えられます。
問4
解答:方法・・・蒸留、理由・・・物質によって沸点がちがうから。
解説:
単純な知識問題なので、解説略。
大問8 植物の観察
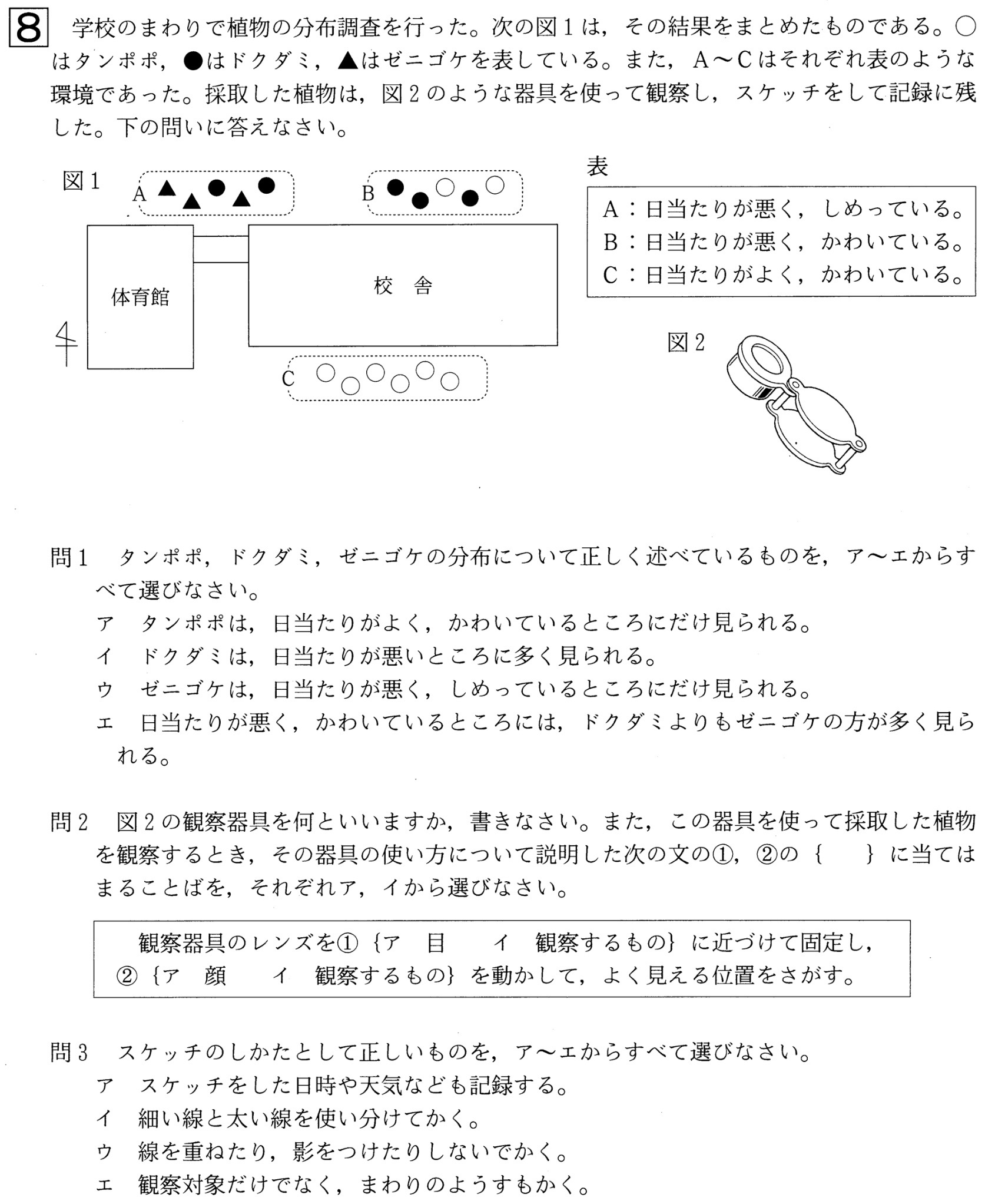
問1
解答:イ、ウ
解説:
単純な知識問題なので、解説略。
問2
解答:器具・・・ルーペ、使い方①・・・ア、②・・・イ
解説:
ルーペは目に近づけ、観察する物体が動かせるときは物体を動かしてピントを合わせます。観察する物体が動かせないときは、顔を動かしてピントを合わせます。
問題文に「採取した植物を観察するとき」とあるので、ルーペを目に近づけ、観察するものを動かしてピントを合わせます。
問3
解答:ア、ウ
解説:
単純な知識問題なので、解説略。
大問9 被子植物の特徴

問1
解答:①部分・・・B、①名前・・・やく、②部分・・・A、②名前・・・柱頭
解説:
図1はサクラの花の断面図です。サクラは被子植物のうちの双子葉類の離弁花類に属する植物なので、被子植物の受粉を考えます。
花の基本4要素は外側から順に、がく→花弁→おしべ→めしべ、です。
被子植物の受粉では、おしべのやく(B)の中にある花粉がめしべの柱頭(A)につくことです。
問2
解答:果実
解説:
受粉して受精後、めしべにある胚珠(C)は種子に、子房(D)は果実になります。
問3
解答:部分・・・C、名前・・・胚珠
解説:
問2解説参照。
大問10 動植物の分類

問1
解答:分類
解説:
単純な知識問題なので、解説略。
問2
解答:Ⅰ・・・①②③⑥、Ⅱ・・・④⑤
解説:
常識的に考えれば分かる問題なので、解説略。
問3
解答:イ、エ
解説:
常識的に考えれば分かる問題なので、解説略。
問4
解答:生活場所が水中か陸上か。
解説:
常識的に考えれば分かる問題なので、解説略。