第1問
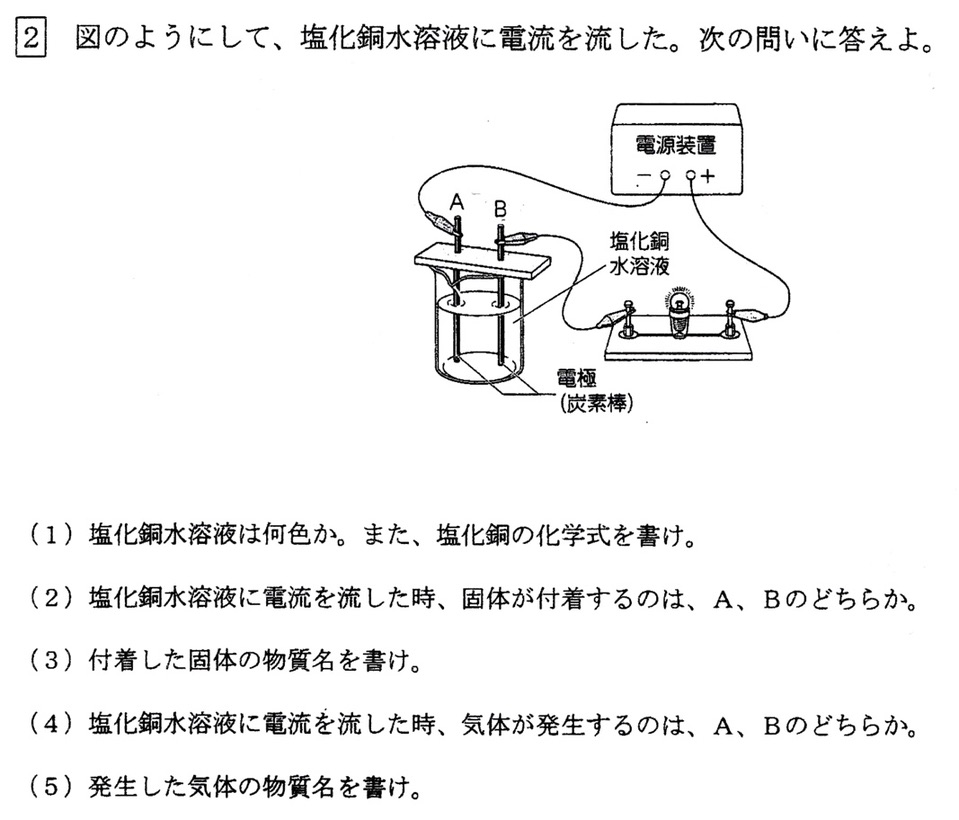
(1)
塩化銅(化学式:CuCl2)の電離式は、
CuCl2→Cu2++2Cl–
銅イオン(Cu2+)が含まれているので、塩化銅水溶液の色は青色です。
(2)
塩化銅の電離式は、
CuCl2→Cu2++2Cl–
陽極(B)に引き寄せられた塩化物イオン(Cl–)が放出した電子を、陰極(A)に引き寄せられた銅イオンが受け取り(Cu2+)、固体の銅(赤色)になります。
(3)
(2)解説参照。
(4)(5)
陽極(B)に引き寄せられた塩化物イオン(Cl–)が電子を放出し、気体の塩素が発生します。
第2問

(1)
塩酸は、気体の塩化水素(HCl)が水にとけた水溶液です。
(2)
塩化水素が水にとけたときの電離式は、以下の通りです。
HCl→H++Cl–
(3)
マイナスとプラスはくっつくので、
塩化物イオン(Cl–)は陽極に引き寄せられ、電子を放出して気体の塩素が発生します。
水素イオン(H+)は陰極に引き寄せられ、電子を受け取って気体の水素が発生します。
(4)
陽極で発生した気体の塩素は水に溶けやすいため、水素の方が多く発生したように見えます。
スポンサーリンク
第3問
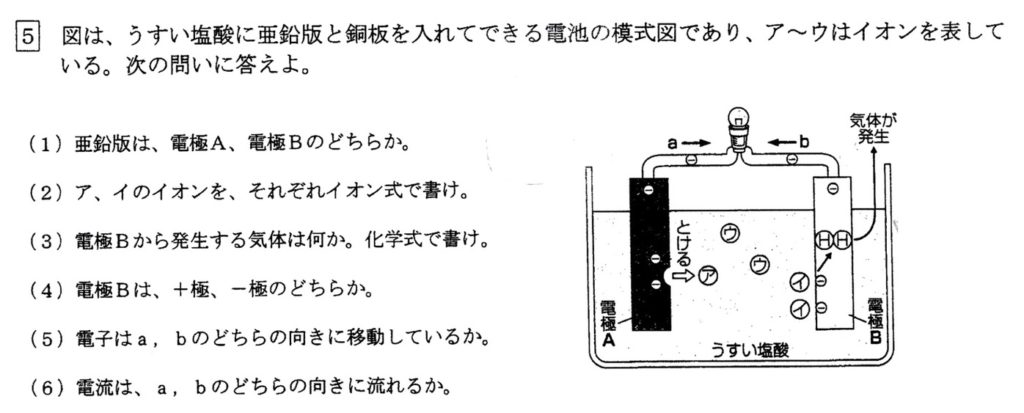
(1)
亜鉛は銅よりイオン化傾向が大きく、酸に溶けて電子を放出しやすいので、電極Aになります。
(2)(3)
ア:亜鉛が酸に溶けると、電子を2個放出して、亜鉛イオン(イオン式:Zn2+)になります。
イ:亜鉛が放出した電子2個は銅板にいき、塩酸(HCl)から電離した水素イオン(H+)が受け取り、銅板から気体の水素(化学式:H2)の膜が発生してしまいます(ボルタの電池の欠点)。
(4)(5)
銅板である電極Bは、亜鉛板から発生した電子を受け取っていること、電流が銅板から流れていることから、+極です。
電子の流れは(a)、これより、電流の流れは(b)です。
第4問
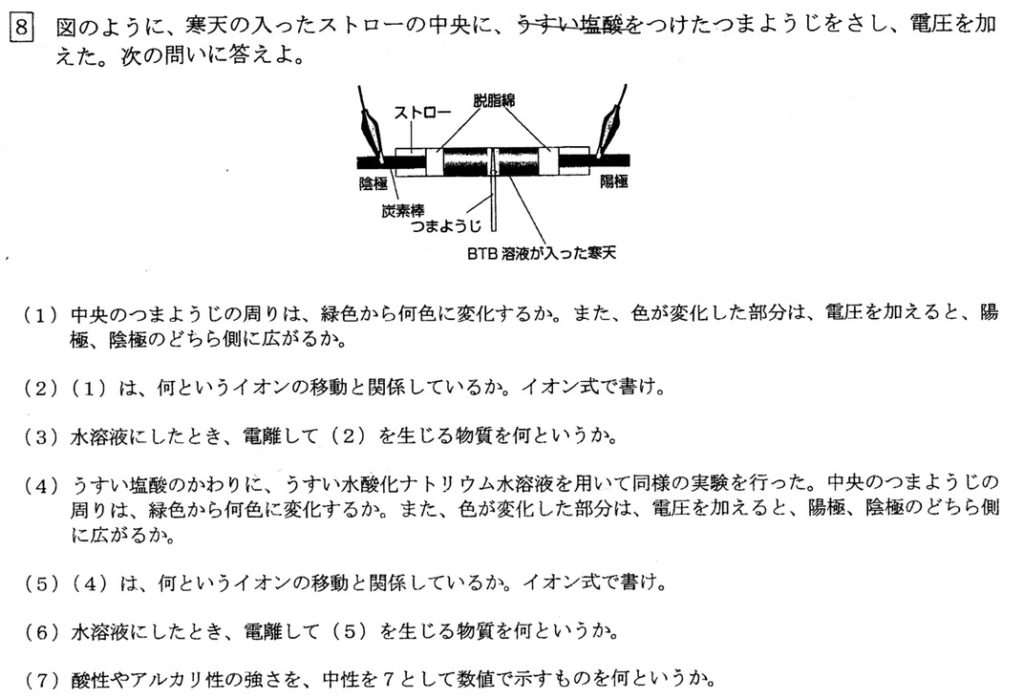
(1)(2)
塩酸は酸なので、BTB溶液の色が緑色から黄色に変化します。
酸の性質を示すのは水素イオン(イオン式:H+)より、電圧を加えると色が陰極側に広がっていきます。
(3)
電解質が水に溶け水溶液になったときに水素イオン(H+)を放出する物質を、酸といいます。
(4)(5)
水酸化ナトリウムはアルカリなので、BTB溶液の色が緑色から青色に変化します。
アルカリの性質を示すのは水酸化物イオン(イオン式:OH–)より、電圧を加えると色が陽極側に広がっていきます。
(6)
電解質が水に溶け水溶液になったときに水酸化物イオン(OH–)を放出する物質を、アルカリといいます。
(7)
中性が7より、指標はpHです。