👉教師紹介・料金
※授業料1回1,500円+交通費(コミコミ最大3,000円)・入会金なし・お好きな日時に受講・3回のお試し期間あり(無料教材あり)
☆学力テストはこれで完璧!オリジナル教材☆
👉北海道学力テストはこれで完璧!オリジナル教材+過去問一覧
※過去問の販売はできませんのでご注意ください。
大問1
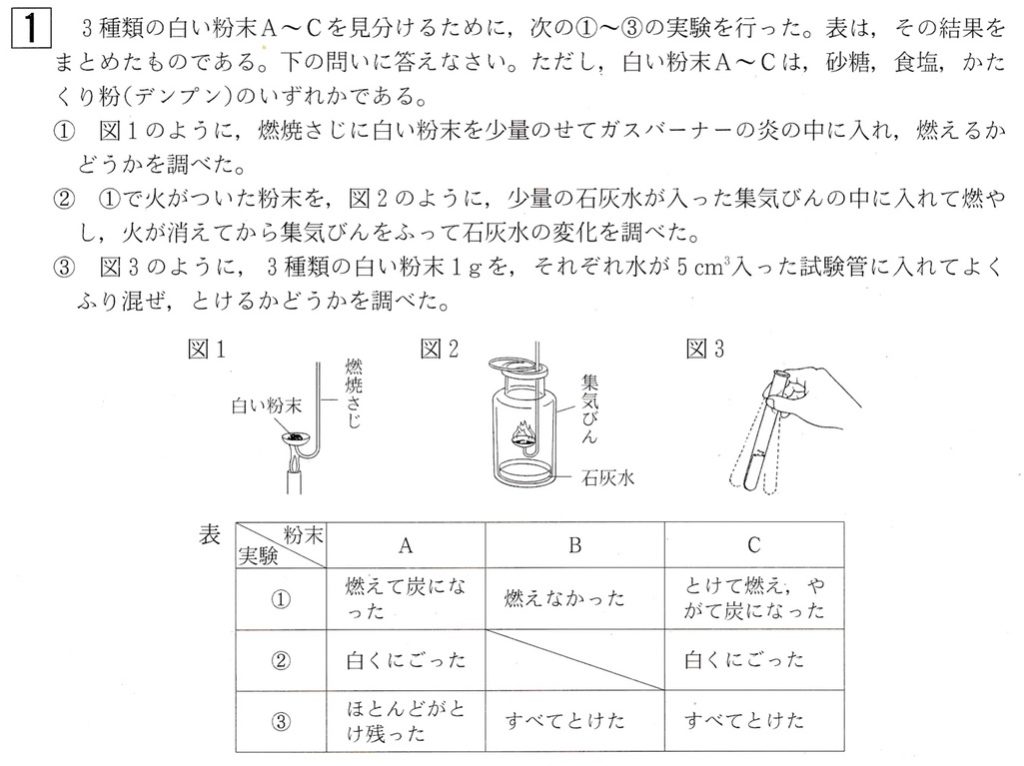

問1
解答:二酸化炭素
解説:
この実験で使用している白い粉末は、砂糖、食塩、かたくり粉(以下、デンプン)です。
このうち、砂糖とデンプンは有機物、食塩(塩化ナトリウム)は無機物です。
有機物は、熱すると燃えて黒こげになり、水と二酸化炭素が発生するので、
砂糖とデンプンを熱したときに発生した気体は、二酸化炭素です。
有機物は、炭素(C)と水素(H)からできている物質で、燃焼させる(酸素(O2)と化合)と炭素は二酸化炭素(CO2)に、水素は水(H2O)になります。
ただしこれは、十分な酸素がある条件下で十分に燃やした場合で、酸素が十分になければ、炭素は炭になったり、一酸化炭素になったりします。
この実験で、有機物であるA(デンプン)とC(砂糖)を熱して炭になったのは、十分な酸素と火力が足りなかったからです。
無機物である食塩(塩化ナトリウム)は、熱しても燃えないでパチパチはねるだけです。
塩化ナトリウムの融点は801℃と高温であるため、燃焼さじで熱しても溶けません。
問2
解答:炭素
解説:
図2の実験で石灰水が白く濁った場合、集気びんの中に二酸化炭素(CO2)があることが分かります。
白い粉末AとCを集気びんの中で燃やした(酸素(O2)と化合)後、集気びんをふると石灰水が白く濁ったことから、白い粉末AとCには炭素(C)が含まれていることが分かります。
なお、石灰水とは水酸化カルシウム(Ca(OH)2)のことです。
水酸化カルシウムは水溶液中に水酸化物イオン(OH–)があるので、アルカリ性です。
水酸化カルシウム水溶液に二酸化炭素(CO2)が溶けると炭酸(H2CO3)となり、水素イオン(H+)が放出されるので、酸性の性質を示します。
アルカリ性の水酸化カルシウムに、酸性の炭酸が加わることで中和が起こり、炭酸カルシウム(CaCO3)の塩が発生します。
炭酸カルシウムは白色の固体で、水にとけにくいため、水溶液中に拡散します。
石灰水を入れた集気びんをふると白く濁るのは、炭酸カルシウムが水溶液中に拡散しているためです。
この状態でさらに二酸化炭素を流すと、炭酸カルシウムは水に溶けやすい炭酸水素カルシウムとなり、水溶液は再び透明になります。
問3
解答:水滴がついてくもった
解説:
②のとき、白い粉末AとCを集気びんの中で燃やす(酸素(O2)と化合する)と、集気びんの内側に白いくもりができます。
この白いくもりに塩化コバルト紙をつけると、青色から赤色に変化するので、水(H2O)ができたことが分かります。
そして、このことから、白い粉末AとCには水素(H)が含まれていることが分かります。
問4
解答: 砂糖:C、食塩:B
解説:
表より、実験①で白い粉末AとCが燃えて炭になったことから、白い粉末AとCは有機物である砂糖かデンプンです。
白い粉末Bでは加熱しても変化が見られなかったことから、白い粉末Bは食塩(塩化ナトリウム)であることが分かります。
実験②で白い粉末AとCでは石灰水が白く濁ったことから、白い粉末AとCは同様に有機物である砂糖かデンプンです。
実験③で白い粉末Aは水にほとんど溶けなかったことから、白い粉末Aはデンプンであることが分かります。
白い粉末Cはすべて溶けたことから、白い粉末Cは砂糖であることが分かります。
問題では、白い粉末として、砂糖・デンプン・食塩の3つを使用して、3つの観点で実験を行っています、
このほかに、白い粉末として、重そう(炭酸水素ナトリウム)と炭酸ナトリウムの場合について、3つの観点で実験を行った場合のようすも押さえておきましょう。
大問2
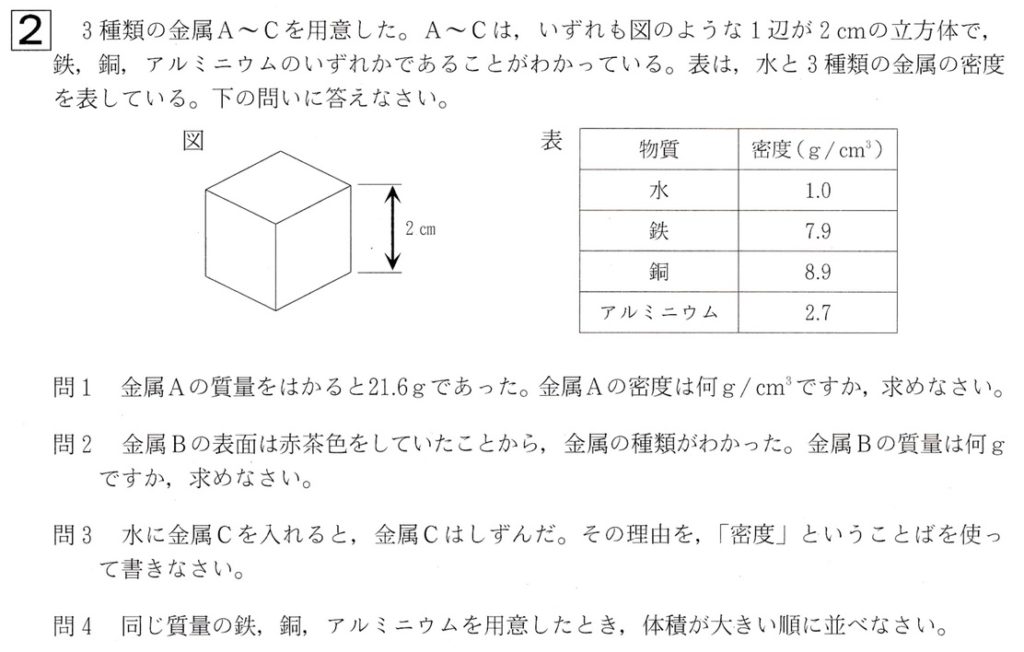
問1
解答:2.7g/cm3
解説:
単なる単位計算の問題です。
金属A〜Cは1辺が2cmの立方体より、体積は、2cm×2cm×2cm=8cm3です。
金属Aの質量は21.6gです。
密度の単位「g/cm3」は、分子が質量(g)で分母が体積(cm3)です。
ゆえに、金属Aの密度(g/cm3)は、21.6g/8cm3=2.7g/cm3となり、表より、金属Aはアルミニウムであることが分かります。
問2
解答:71.2g
解説:
金属Bの表面が赤茶色をしていたことから、金属Bは銅であることが分かります。
銅(Cu)の色が問われる題材として、以下のようなものがあります。
・銅と硫黄の化合
Cu(赤色)+S(黄色)→CuS(黒色)、質量比は、Cu:S:CuS=2:1:3
・銅の酸化
2Cu(赤色)+O2→2CuO(黒色)、質量比は、Cu:O2:CuO=4:1:5(「銅はよいこ」と覚えるとよいです)
・酸化銅の炭素による還元
2CuO(黒色)+C→2Cu(赤色)+CO2
・酸化銅の水素による還元
CuO(黒色)+H2→2Cu(赤色)+H2O
・塩化銅の電気分解
CuCl2→Cu(陰極で赤色の銅が付着)+Cl2
・銅板と亜鉛板を用いた化学電池(ボルタの電池)
これはイオン化傾向についての問題で、銅の色とは関係ありません。
問3
解答:金属Cの密度が水の密度より大きいから
解説:
液体と固体において、
液体の密度が固体より小さい場合、密度が大きい固体は液中に沈みます。
液体の密度が固体より大きい場合、密度が小さい固体は浮きます。
液体の密度と固体の密度が等しい場合、固体は液体中で静止します。
表で与えられている水の密度1.0g/cm3は、4℃の水の密度です。
4℃の水に金属Cを入れると、金属Cは沈んだことから、金属Cの密度は水の密度より大きいことが分かります。
問4
解答:アルミニウム→鉄→銅
解説:
密度の単位(g/cm3)から、体積(cm3)を算出する場合、質量(g)を密度(g/cm3)で割ります。
同一質量(g)の場合、分母の密度(g/cm3)が大きいほど体積(cm3)が小さくなります。
密度(g/cm3)がアルミニウム<鉄<銅より、体積(cm3)はアルミニウム>鉄>銅、となります。
ここで、1/A:1/B=B:Aと逆比となるので、同一質量(g)の場合、体積比は密度(g/cm3)の逆比となります。
密度(g/cm3)の単位で、質量(g)が分子にあることから、同一体積(cm3)の場合、質量(g)比は密度(g/cm3)の比となります。
2020年の北海道公立高校入試理科で、この考え方を使わないとラクに解けない問題が出題されています。
必ず押さえておきましょう。
大問3
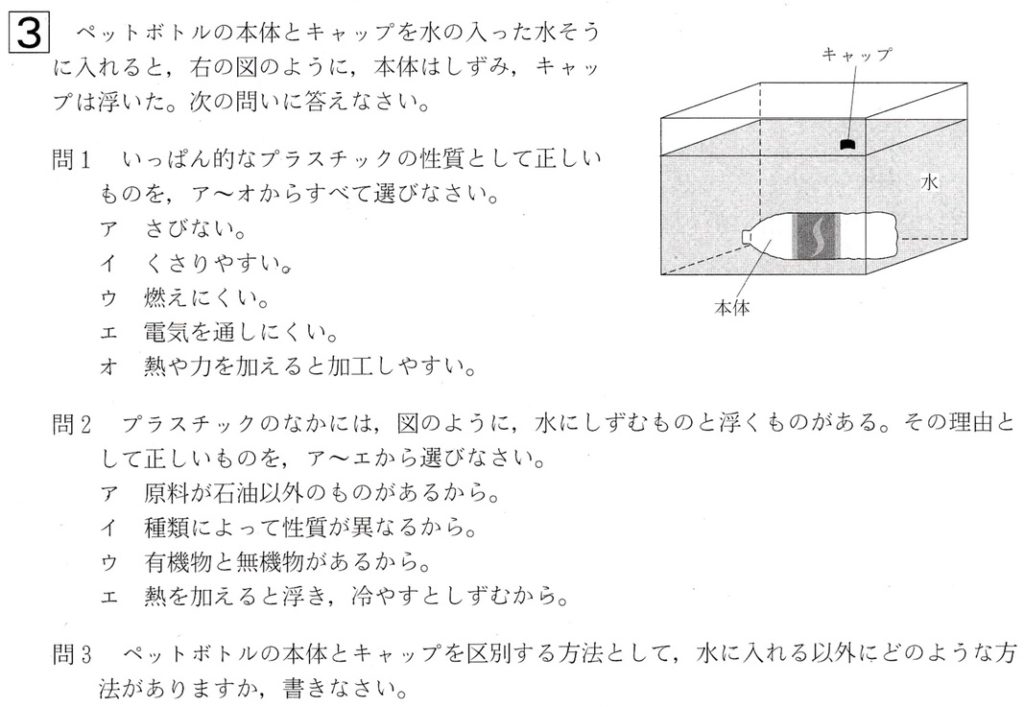
問1
解答:ア、エ、オ
解説:
プラスチックの原料は、ほとんどが石油(ナフサ)です。
石油は有機物であるので、燃やすと二酸化炭素と水が発生します。
プラスチックの性質として、以下の4つがあります。
①軽くてしなやか
②熱や油、薬品に強い
③耐水性、可塑性(変形した物体が元の形に戻らない性質)にすぐれている
④生分解性プラスチックは、土のなかで微生物により分解される
以上より、答えが出せます。
問2
解答:イ
解説:
プラスチックの種類として、以下の4種類を押さえておきましょう。
・ポリエチレンテレフタレート(PET):燃やすと多少のすすがでる
・ポリエチレン(PE):水に浮く
・ポリスチレン(PS):すすを出しながら燃える
・ポリプロピレン(PP):水に浮く
ポリエチレン(PE)とポリプロピレン(PP)以外は、4℃の水(密度 1.0g/cm3)より密度が大きいため、水に沈みます。
問3
解答:燃え方のちがいを調べる
解説:
問2解説参照。
大問4
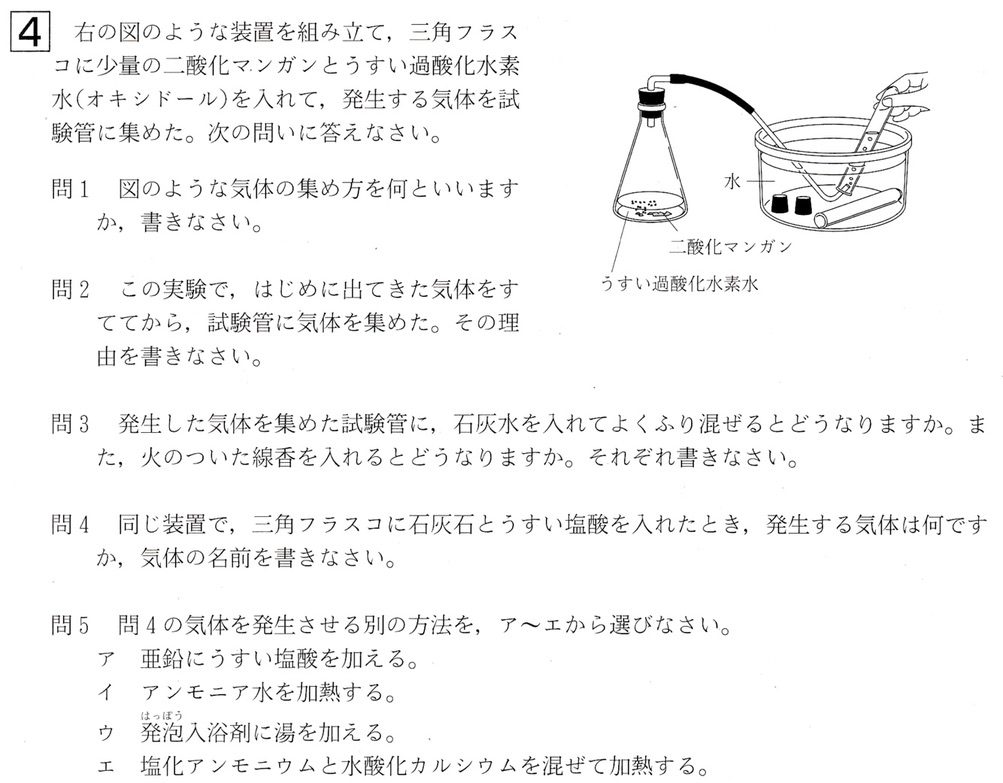
問1
解答:水上置換法
解説:
図は、水上置換法による酸素の捕集方法です。
二酸化マンガンにうすい過酸化水素水を加えると、酸素が発生します。
化学反応式は、
2H2O2→2H2O+O2
二酸化マンガンは過酸化水素水の分解を助けるだけで、自身は変化しない触媒なので、繰り返し使用できます。
それゆえ、この実験で発生する酸素の量(cm3)は、過酸化水素水の量(cm3)や濃度(質量パーセント濃度)に依存します。
なお、二酸化マンガンの代用として、生のレバー(牛などの肝臓)、生のジャガイモなど、酵素を含むもので代用可能です。
酸素の性質として、以下の4つを押さえましょう。
①無色・無臭、②空気よりやや重い(空気の約1.1倍)、③水にとけにくい、④助燃性をもつ
水上置換法は、水にとけにくい性質の気体の捕集に用いられます。
水上置換法で捕集される気体として、このほかに、水素や二酸化炭素があります。
問2
解答:はじめに出てくる気体には、三角フラスコ内にあった空気が混ざっているから
解説:
解答例のとおりです。
酸素の捕集以外にも、二酸化炭素、水素の捕集でも同様の理由で、はじめに出てくる気体を集めません。
問3
解答: 石灰水:変化しない、線香:線香が炎をあげて激しく燃える
解説:
中学理科では、石灰水と反応するのは、二酸化炭素のみです。
酸素は助燃性をもつので、火のついた線香を入れると、炎を上げて激しく燃えます。
ただし酸素自身は変化しないことに注意が必要です。
水素の場合、マッチの火を近づけると、ポンっと音を立てて燃えますが、このとき水素と酸素が化合して水が発生し、水素は水に変化しています。
問4
解答:二酸化炭素
解説:
二酸化炭素の発生法として、以下の3つを押さえましょう。
①石灰石+うすい塩酸→塩化カルシウム+水+二酸化炭素
→酸素の捕集法と同じ実験装置で、二酸化炭素を捕集できます。
→石灰石の主成分は炭酸カルシウムなので、同じ炭酸水素カルシウムが主成分の、卵の殻、貝殻、大理石(堆積岩である石灰岩の変成岩)、チョークの粉などで代用できます。
②炭酸水素ナトリウム→炭酸ナトリウム+水+二酸化炭素
③炭酸水素ナトリウム+うすい塩酸→塩化ナトリウム+水+二酸化炭素
問5
解答:ウ
解説:
ア:水素の発生法のひとつです。このほか、マグネシウムにうすい塩酸を加えても水素が発生します。
イ:アンモニアの発生法のひとつです。
ウ:正しい
エ:アンモニアの発生法のひとつです。このほか、塩化アンモニウムと水酸化ナトリウムを加熱してもアンモニアが発生します(水酸化ナトリウムの溶解熱により、加熱をしなくても反応が連鎖的に進む発熱反応)。また、炭酸アンモニウムを熱分解してもアンモニアが発生します(二段階反応)
大問5

問1
解答:
解説:
砂糖(溶質:溶けるもの)を水(溶媒:溶かすもの)に入れると、水の粒子(分子:H2O)が砂糖の粒子(分子)に衝突し拡散し、かき混ぜなくてもやがて溶けて、液全体に均一に広がります。
塩化ナトリウム(食塩)も水によく溶ける物質なので、砂糖の場合と同様に、かき混ぜなくてもやがて溶けて、液全体に均一に広がります。
こうしてできた砂糖水や食塩水などを、水溶液といいます。
水溶液の特徴として、①透明(有色でもよい)、②濃さが均一、の2つがあります。
ただし牛乳の粒子は、砂糖などの粒子などより大きく、コロイド粒子といいます。コロイド粒子が液の中に均一に散らばっている溶液を、コロイド溶液といいます。
問2
解答: とけている物質:溶質、とかしている液体:溶媒
解説:
問1解説参照。
問3
解答:105g
解説:
塩化ナトリウムが水に完全に溶けた水溶液の質量は、塩化ナトリウムの質量5g+水の質量100g=105gです。
このときの塩化ナトリウム水溶液の質量パーセント濃度は、5g/105g×100≒4.7%です。
大問6
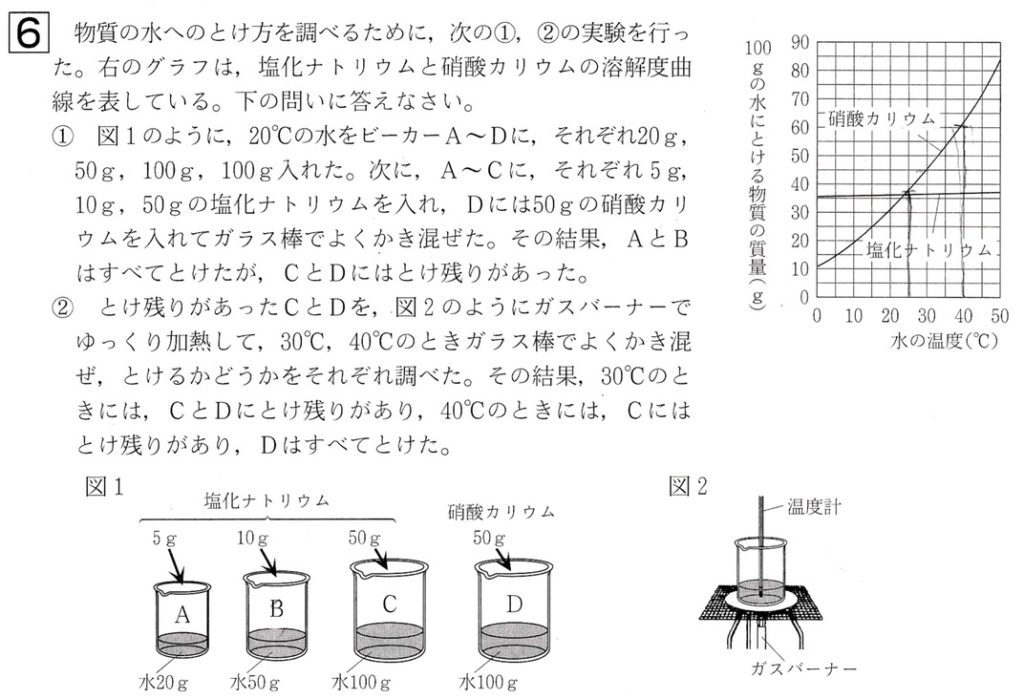

問1
解答:20%
解説:
質量パーセント濃度(%)=塩(g)/水(g)+塩(g)×100=塩(g)/水溶液(g)×100
図1のビーカーの塩化ナトリウム水溶液(食塩水)には、塩化ナトリウム(食塩)が5g、水が20g含まれているので、質量パーセント濃度は、
質量パーセント濃度(%)=5(g)/20(g)+5(g)×100=5/25×100=5×4=20%
問2
解答:31%
解説:
溶解度とは、水100gに溶ける溶質の限界の質量です。
硝酸カリウム30℃の溶解度が45gとは、30℃・100gの水に硝酸カリウムは45gまで溶けるということです。
質量パーセント濃度とは、溶けている物質に対しての濃度です。
実験②の場合、30℃・100gの水に硝酸カリウムは45gまで しか溶けないので、水溶液には100gの水と45gの硝酸カリウムが含まれていることになり、質量パーセント濃度は、
質量パーセント濃度(%)=45(g)/45(g)+100(g)×100=45/145×100=9/29×100=900/29=31.03・・・≒31%
問3
解答:イ
解説:
再結晶の方法として、①水溶液を冷やして取り出す、②水溶液を蒸発させて取り出す、の2つがあります。
①水溶液を冷やして取り出す
温度を下げると溶解度が大きく変化する物質に用いられます(温度による溶解度の変化が大きい)。
溶解度曲線を見ると、硝酸カリウムは温度を下げると溶解度が大きく変化するので、硝酸カリウムの再結晶には水溶液を冷やして取り出す方法が用いられます。
②水溶液を蒸発させて取り出す
温度を下げても溶解度があまり変化しない物質に用いられます(温度による溶解度の変化が小さい)。
溶解度曲線を見ると、塩化ナトリウムは温度を下げても溶解度があまり変化しないので、塩化ナトリウムの再結晶には水溶液を蒸発させて取り出す方法が用いられます。
硝酸カリウムは温度による溶解度の変化が大きい、塩化ナトリウムは温度による溶解度の変化が小さいことは、溶解度曲線と合わせて覚えましょう。
硝酸カリウムの再結晶において、以下の2パターンの問題が出題されます。
①この温度ですべて溶けるか否か
→実験内容を溶解度曲線に合わせる。具体的には、実験で用いた水の質量を100gになるよう、水と溶媒の質量を等倍する。
②温度を下げたとき何gの結晶が析出するか
→溶解度曲線を実験内容に合わせる。具体的には、溶解度曲線の水の質量100gを、実験で用いている水の質量になるよう等倍する。
この問題では、②のパターンの問題なので、溶解度曲線を実験内容に合わせます。
といっても、この問題では実験で100gの水を用いているので、溶解度曲線をそのまま使用できます。
溶解度曲線を見ると、硝酸カリウムは40℃・100gの水に約62g溶けます。
実験では40℃・100gの水に硝酸カリウム50gを加えているので、硝酸カリウムはすべて溶けています。
ここから硝酸カリウム水溶液を25℃まで下げたとき、溶解度曲線を見ると、硝酸カリウムは20℃・100gの水に約37g溶けるので、析出する硝酸カリウムの結晶の質量は、
50g – 約37g≒13g
選択肢を見て、この値に最も近いのは、選択肢イです。
問4
解答:水を加えて、かき混ぜる
解説:
溶け残りを全て溶かすには、①温度を上げる、②水(溶媒)を加えてかき混ぜる、の2つの方法があります。
しかし塩化ナトリウムは、温度による溶解度の変化が小さい物質です。
教科書などを見ると分かるのですが、塩化ナトリウムの溶解度は、80℃でも約38gほどです。
ビーカーCの塩化ナトリウムは50gなので、温度を上げてもすべて溶けません。
水が液体として存在していられるのは100℃までなので、この温度範囲で塩化ナトリウムは100gの水に50gの塩化ナトリウムをすべて溶かすことはできません。
ゆえに、溶け残った塩化ナトリウムを全て溶かすには、②水(溶媒)を加えてかき混ぜる、の方法を採用します。
例えば、与えられた溶解度曲線を見ると、塩化ナトリウムの溶解度は、50℃でも約35gほどなので、
水の質量を150gにすると、溶ける塩化ナトリウムの質量は1.5倍されて、約52gとなり、
50gの塩化ナトリウムはすべて溶けます。
大問7
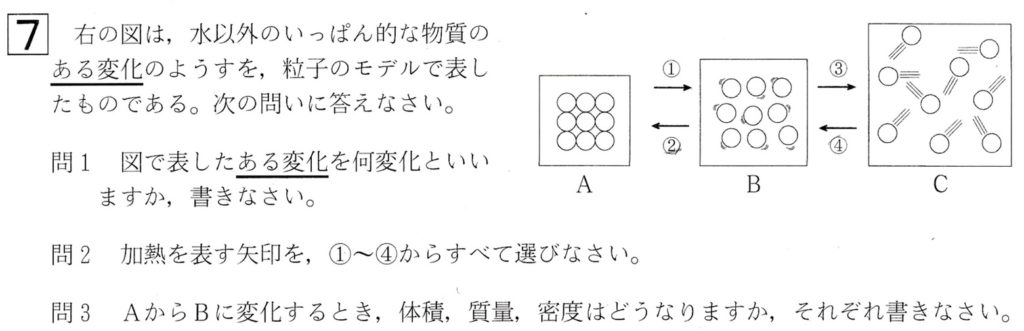
問1
解答:状態変化
解説:
問題文の図は状態変化のモデルです。
問題文の図において、水以外の場合、Aは固体、Bは液体、Cは気体です。
AからBの変化①を融解、BからAの変化②を凝固、BからCの変化③を気化、CからBの変化④を液化、AからCまたはCからAの変化を昇華といいます。
なお、A、B、Cの粒子の数はともに9つなので、質量はA、B、Cどの状態においても同じです。
それゆえ、密度(g/cm3)はA>B>Cの順になり、同じ物質では固体は液体に沈みます。
水の場合、Aは固体で粒子の動きも一般的な物質と同じです。
Bのとき粒子の動きは一般的な物質と同じですが、体積がAより小さくなります。
水は4℃のとき体積が最小となり、密度が最大(1.0g/cm3)となります。
それゆえ、氷は水に浮きます。
氷が表面から凍るのは、0℃の水が4℃の水より密度が小さいため、水面に移動し、水面に移動した0℃の水から凍るためです。
Cのときは、粒子の動きも体積も一般的な物質と同じです。
問2
解答:①、③
解説:
加熱をすることで熱エネルギー(J)が物質に供給されます。
エネルギー(J)は移り変わります。
供給された熱エネルギー(J)は、粒子の運動エネルギー(J)に代わり、粒子の動きが大きくなります。
問3
解答: 体積:大きくなる、質量:変わらない、密度:小さくなる
解説:
図において、固体から液体に変化するとき、体積(cm3)が大きくなります。
粒子の数は9つで同じなので、質量(g)は変わりません。
ゆえに、密度(g/cm3)は、分子の質量(g)が一定で、分母の体積(cm3)が大きくなるので、密度(g/cm3)は小さくなります。
大問8
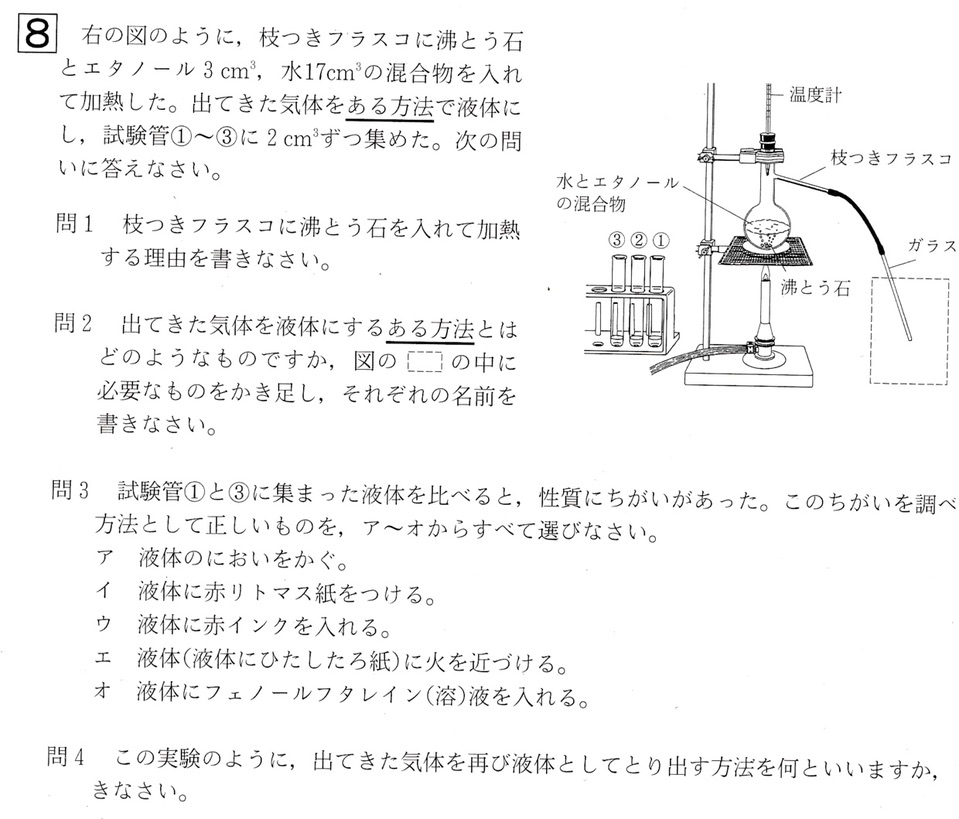
問1
解答:液体が急に沸とうするのを防ぐため
解説:
水とエタノールの混合液の蒸留の実験です。
枝つきフラスコの形と名前は覚えましょう。
沸とう石を入れるのは、中の液体が急に沸とうするのを防ぐため(突沸を防ぐため)です。
沸とう石を入れる場合として、蒸留の他に、ベネジクト液を加熱する場合もあります。
ベネジクト液は、ブドウ糖やブドウ糖がいくつか結合したもの(麦芽糖)の検出に用いられる試薬で、これらがあると青色から黄色(糖の濃度が低い)〜赤褐色になります。
この赤褐色は、酸化銅の沈殿です。
問2
解答:
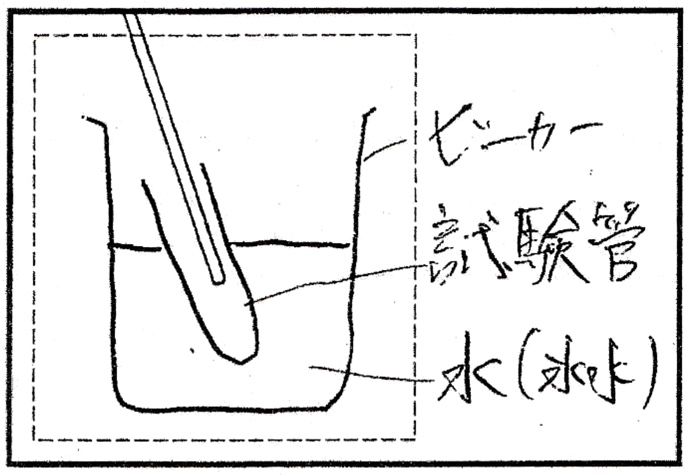
解説:
蒸留の操作と注意点として、以下の4つを押さえましょう。
①沸騰石を入れて突沸を防ぐ
②ガラス管をたまった液につけない(※)
③試験管は水で冷却する
④ガラス管は火を消す前に試験管から出す(※)
※枝つきフラスコが冷えると、フラスコ内の気圧が下がり、外気を吸うため、試験管の中の液体が逆流することがあるから。炭酸水素ナトリウムの熱分解の実験も同様の理由で、ガラス管は火を消す前に試験管から出します。
問3
解答:ア、エ
解説:
蒸留は、物質の沸点の違いを利用して、混合物を純粋な物質に分ける方法です。
純粋な水の沸点は100℃ですが、純粋なエタノールの沸点は78.3℃と、純粋な水の沸点より低いです。
それゆえ、蒸留を進めると、最初はエタノールを多く含む液体が得られ、徐々に水が多く出てきます。
試験管①はエタノールを多く含む液体、試験管③は水を多く含む液体です。
ア:正しい。直接かぐのではなく、手で仰いでにおいをかぎます。
イ:エタノールは砂糖水と同様に非電解質の物質で、水溶液中で電離しません。ゆえにエタノール水溶液中には、酸性の性質を示す水素イオン(H+)もアルカリ性の性質を示す水酸化物イオン(OH–)も存在しないので、リトマス紙を用いるのは適切ではありません。
ウ:塩素の漂白作用を調べるのに用いる方法です。赤インクは、塩酸や塩化銅の電気分解で登場します。
エ:正しい。試験管①は燃え、試験管③は燃えないと予想されます。
オ:選択肢イと同様に、アルカリ性の性質を調べる試薬であるフェノールフタレイン溶液を用いるのは適切ではありません。
問4
解答:蒸溜
解説:
解答の通りです。
大問9

問1
解答: A:やく、中のもの:花粉
解説:
花の4要素は、外側から、がく・花弁・おしべ・めしべの順です。
Aはおしべのやく、Bはめしべの柱頭、Cはめしべの胚珠、Dはめしべの子房です。
おしべのやくにの中には花粉母細胞(核相2n)があり、そこから成熟花粉(核相n、生殖細胞(精細胞)なので減数分裂して染色体の数が半分になっている)が作られます。
花粉がめしべの柱頭に付着することが受粉で、受粉後、花粉管の伸張により精細胞が胚珠の中の卵細胞(核相n)と受精し受精卵となります。
受精後、胚珠は種子に、子房は果実に、受精卵は胚となります。
なお、生殖細胞の呼び方は、被子植物の場合は精細胞と卵細胞、動物の場合は精子と卵です。
被子植物は、子葉の枚数により単子葉類(1枚)と双子葉類(2枚)に分類され、双子葉類はさらに花弁の付き方により、合弁花類と離弁花類に分類されます。
単子葉類として、イネ・トウモロコシ・スズメノカタビラ・ユリ・アヤメ・ツユクサ・チューリップを、
合弁花類として、ツツジ・タンポポ・アサガオを、
離弁花類として、サクラ・アブラナ・エンドウを、
それぞれ覚えましょう。
問2
解答:柱頭
解説:
問1解説参照。
問3
解答: C:胚珠、D:子房
解説:
問1解説参照。
問4
解答: ①受粉、②果実、③種子
解説:
問1解説参照。
大問10

問1
解答:プレパラート
解説:
実験器具のひとつ、プレパラートの問題です。
スライドガラスの上に観察物をのせ、カバーガラスをかけたものをプレパラートといいます。
プレパラートを作成するときの注意点は、カバーガラスをかけるとき、中に気泡が入らないように、カバーガラスを端からゆっくり下ろすことです。
プレパラートは、ステージ上下式顕微鏡(鏡筒上下式顕微鏡)や双眼実体顕微鏡のステージの上に固定して、観察物を観察します。
問2
解答: A:スライドガラス、B:カバーガラス
解説:
問1解説参照。
問3
解答:気泡が入らなくなるため
解説:
問1解説参照。
大問11

問1
解答:ウ→イ→エ→ア
解説:
ステージ上下式顕微鏡の使用手順は、以下の5ステップです。
①接眼レンズ、対物レンズの順に取り付ける(上からゴミが入らないようにするため)
②反射鏡で明るさを調節する
③プレパラートをステージにのせる
④横から見て対物レンズ(低倍率から使用)をプレパラートに近づける
⑤接眼レンズをのぞきながら対物レンズを遠ざけピントを合わせる
プレパラートを近づけてから遠ざけてピントを合わせるのがポイントです。
ステージ上下式顕微鏡の特徴として、以下の3つがあります。
①接眼レンズは短いものほど、対物レンズは長いものほど倍率が高くなる
②顕微鏡の倍率が2倍、3倍・・・になると、視野と明るさは、1/4倍、1/9倍・・・になる(倍率が上がると視野が狭く暗くなる)
③像は上下左右が逆(倒立像)(レンズを通して見える物体を像という)
問2
解答:ミカヅキモ
解説:
水中の生物で、遊泳能力がないか、あっても弱いため水中を浮遊するものをプランクトンといいます。
プランクトンには、光合成を行う植物プランクトン、摂食を行う動物プランクトン、光合成も摂食も行うプランクトンがあり、
さらに、からだのつくりにより、単細胞生物と多細胞生物に分けられます。
プランクトンの例として、以下のものを覚えましょう。
植物プランクトン・多細胞生物→アオミドロ
植物プランクトン・単細胞生物→ミカヅキモ、ケイソウ、ミドリムシ
動物プランクトン・多細胞生物→ミジンコ
動物プランクトン・単細胞生物→ミドリムシ、アメーバ、ゾウリムシ
このうち、ミドリムシはべん毛、ゾウリムシは繊毛、アメーバは仮足、ミジンコは触角を使って動きますが、ミカヅキモは生きているときには自らはほとんど動きません。
問3
解答:ア
解説:
解答の通りです。
問4
解答: 明るさ:暗くなる、広さ:せまくなる
解説:
倍率が4倍になっているので、明るさと視野は1/16倍となり、暗くせまくなります。