👉教師紹介・料金
※授業料1回1,500円+交通費(コミコミ最大3,000円)・入会金なし・お好きな日時に受講・3回のお試し期間あり(無料教材あり)
■総合ABC範囲表
>>【最新版】総合ABC範囲表
■総合A過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年
■総合B過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年、2015年
■総合C過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年、2015年
■総合ABC道コン偏差値
>>総合ABC道コン偏差値(SS)推移
☆過去問ダウンロードはこちら☆
※生徒以外で過去問のみをお求めの方は、こちらにご連絡ください(過去問の「原本」を頂ける方は歓迎します!)。
👉お問い合わせ
大問1

問1
解答:光の速さの方が速いため
解説:
音を伝える物質と音が伝わる速さは、気体<液体<固体の順に速くなります。
例えば、空気中での音が伝わる速さは約340m/s、水中での音が伝わる速さは約1500m/s、鉄の場合は約6000m/s、です。
100m離れた場所の場合、音が空気中を伝わって耳に届くまでにかかる時間は約0.3s(100m÷約340m/s)と、人が認識できる時間分かかります。
これに対して、光の速さは約3億m/sと非常に速いため、点灯してから目に届くまでの時間は無視できるほど小さい(0秒)とみなすことができます。
問2
解答:1360m
解説:
単なる単位計算の問題です。
花火が開いて見えてから4.0秒(4.0s)後にドーンという音が聞こえたことから、
花火の音がAさんに届くまでの時間は4.0sです。
音の速さが340m/sと与えられているので、花火が開いた場所からAさんがいるビルまでの距離は、
340m/s×4.0s=1360m
問3
解答:340m
解説:
音が反射しても、音の速さは変わりません。
花火の音がAさんに届くまでの時間は4.0sです。
花火が開いた側と反対にあるより高いマンションの壁に花火の音が反射して、花火が開いた6.0s後、つまり、花火の音がAさんに届いてから2.0s後(6.0s – 4.0s)に、再び花火の音が聞こえています。
つまり、図を正面に見て、花火がビル→高いマンション→ビルと往復するのに2.0sかかっているので、花火の音が高いマンション→ビルを通過するのにかかる時間は、1.0s(2.0s/2)です。
音の速さが340m/sより、Aさんがいるビルとマンションとの距離は、
340m/s×1.0s=340m
大問2
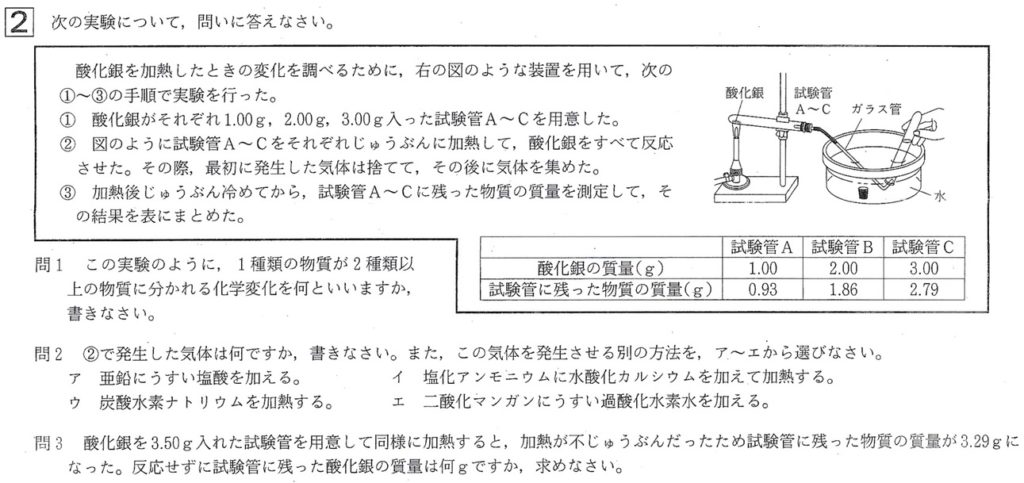
問1
解答:熱分解
解説:
化学変化のうち、1種類の物質から、2種類以上の物質ができる変化を分解といいます。
分解には、熱分解と電気分解などがあります。
熱分解で覚えるのは、
・炭酸水素ナトリウムの熱分解
炭酸水素ナトリウム→炭酸ナトリウム+水+二酸化炭素
・酸化銀の熱分解
酸化銀→銀+酸素(2Ag2O→4Ag+O2)
・炭酸アンモニウムの熱分解
炭酸アンモニウム→アンモニア+水+二酸化炭素
電気分解で覚えるのは、
・水の電気分解
水→水素+酸素(2H2O→2H2+O2)
・塩酸の電気分解
塩酸→水素+塩素(2HCl→H2+ Cl2)
・塩化銅の電気分解
塩化銅→銅+塩素(CuCl2→Cu+Cl2)
問2
解答: 気体:酸素、発生:エ
解説:
酸化銀の熱分解の化学反応式は、以下の通りです。
酸化銀→銀+酸素(2Ag2O→4Ag+O2)
酸化銀を熱分解すると、気体として酸素が発生します。
酸素は助燃性をもつので、火のついた線香を試験管A〜Cに入れると、線香は激しく燃えます。
代表的な気体の性質は、以下の通りです。
■酸素
酸素の性質として、以下の4つを押さえましょう。
①無色・無臭、②空気よりやや重い(空気の重さの約1.1倍)、③水にとけにくい、★④助燃性をもつ
酸素が発生する反応として、以下の例を覚えましょう。
・二酸化マンガンにうすい過酸化水素を加える
・過酸化水素を加熱する
・酸素系漂白剤にお湯を加える
・酸化銀を加熱する
・水を電気分解する
■水素
水素の性質として、以下の4つを押さえましょう。
①無色・無臭、②最も軽い気体(空気の重さの約0.08倍)、③水にとけにくい、★④可燃性をもつ
水素が発生する反応として、以下の例を覚えましょう。
・鉄にうすい塩酸を加える
・亜鉛にうすい塩酸を加える
・マグネシウムにうすい塩酸を加える
・水を電気分解する(水素イオンH+より、陰極で発生)
・塩酸を電気分解する(水素イオンH+より、陰極で発生)
■二酸化炭素
二酸化炭素の性質として、以下の4つを押さえましょう。
①無色・無臭、★②空気より重い(空気の重さの約1.5倍)、③水に少しとける(H+を放出する酸より水溶液は酸性)、★④石灰水を白く濁らせる
二酸化炭素が発生する反応として、以下の例を覚えましょう。
・石灰水にうすい塩酸を加える
・炭酸水素ナトリウムを加熱する
・炭酸水素ナトリウムにうすい塩酸を加える
・炭酸アンモニウムを加熱する
・酸化銅に炭素を加えて加熱する
■窒素
空気の約8割を占める窒素は、以下の5つの性質を持ちます。
①無色・無臭、②空気より少しだけ軽い、③水に溶けにくい、④助燃性(O2)・可燃性(H2)なし
★⑤常温では他の物質と結びついて化学変化を起こすことはほとんどない(この性質を利用した食品の酸化を防ぐ方法に、窒素充填がある)
■アンモニア
アンモニアの性質として、以下の4つを押さえましょう。
★①無色・刺激臭、★②空気より軽い、★③水に非常によく溶ける(20℃の水1cm3に702cm3溶ける)(OH–を放出するアルカリより水溶液はアルカリ性)→アンモニアの噴水実験、★④塩化水素と反応し、白煙(塩化アンモニウムの白色の固体)を生じる
アンモニアが発生する反応として、以下の例を覚えましょう。
・塩化アンモニウムと水酸化カルシウムの混合物を加熱する
・塩化アンモニウムと水酸化ナトリウムの混合物を加熱する(発熱反応)
・塩化アンモニウムと水酸化バリウムの混合物を加熱する
・炭酸アンモニウムを加熱する
問3
解答:0.50g
解説:
酸化銀の熱分解の化学反応式は、以下の通りです。
酸化銀→銀+酸素(2Ag2O→4Ag+O2)
化学変化では、反応の前後で物質全体の質量は変化しません。
これを質量保存の法則といい、1774年にフランスの科学者ラボアジェによって発見されました。
また、物質の中に含まれている成分の割合は、化合物(2種類以上の原子からなる純物質)ごとに決まっており、化合物の質量にかかわらず一定です。
これを定比例の法則といい、1799年にフランスの科学者プルーストによって発見されました。
酸化銀を熱分解すると、銀と酸素が発生します。
質量保存の法則より、酸化銀の質量=銀の質量+酸素の質量、が成り立ちます。
上の式を変形して、酸素の質量=酸化銀の質量 – 銀の質量、となります。
問題文に、「試験管A〜Cをそれぞれじゅうぶんに加熱して酸化銀をすべて反応させ」とあるので、酸化銀はすべて銀と酸素に分解されています。
よって、表の値を用いて、
試験管Aでは1.00gの酸化銀から0.07g(1.00g – 0.93g)の酸素が、
試験管Bでは2.00gの酸化銀から0.14g(2.00g – 1.86g)の酸素が、
試験管Cでは3.00gの酸化銀から0.21g(3.00g – 2.79g)の酸素が、
それぞれ発生しており、試験管A〜Cを見ると、酸化銀の質量が2倍、3倍となると、発生する酸素の質量も2倍、3倍となり、定比例の法則が成り立っていることが分かります。
以上の知識をもとに、問題を解きます。
(解き方1)
この問題では、酸化銀3.50gを熱分解すると、酸化銀と銀の混合物3.29gと酸素0.21g(3.50g – 3.29g)が生じています。
1.00gの酸化銀から0.07gの酸素が発生するとは、1.00gの酸化銀が過不足すべて反応した場合、0.07gの酸素が発生するという意味です。
これより、0.21gの酸素が発生したとき、1.00g×3=3.00gの酸化銀が過不足すべて反応したということになります。
3.50gの酸化銀のうち3.00gの酸化銀が過不足すべて反応したので、未反応の酸化銀の質量は0.50g(3.50g – 3.00g)です。
(解き方2)
この問題では、酸化銀3.50gを熱分解すると、酸化銀と銀の混合物3.29gと酸素0.21g(3.50g – 3.29g)が生じています。
1.00gの酸化銀から0.93gの銀と0.07gの酸素が発生するとは、1.00gの酸化銀が過不足すべて反応した場合、0.93gの銀と0.07gの酸素が発生するという意味です。
これより、0.21gの酸素が発生したとき、0.93g×3=2.79gの銀が発生します。
酸化銀と銀の混合物3.29gに2.89gの銀が含まれているので、混合物3.29gに含まれる未反応の酸化銀の質量は0.50g(3.39g – 2.89g)です。
大問3

問1
解答:発熱反応
解説:
発熱反応の例として、以下の反応を覚えましょう。
・鉄と硫黄の化合
鉄+硫黄→硫化鉄(Fe+S→FeS)
・塩化アンモニウムと水酸化ナトリウムの反応
塩化アンモニウム+水酸化ナトリウム→アンモニア+塩化ナトリウム+水
※水酸化ナトリウムの溶解熱で反応が進む
選択肢ウの炭酸水素ナトリウムの熱分解と、選択肢エのアンモニアの発生法は、吸熱反応です。
多くの反応が吸熱反応なので、発熱反応の例を覚えることが重要です(少ない方を覚えることが重要)。
問2
解答:ウ
解説:
化学変化のうち、2種類以上の物質が結びついて、まったく別の新しい物質ができる変化を、化合といいます。
化合の例として、以下の例を覚えましょう。
・鉄と硫黄の化合
鉄+硫黄→硫化鉄(Fe+S→FeS)
質量比は、Fe:S:FeS=7:4:11、です。
鉄の色は灰色、硫黄は黄色、硫化鉄は黒色です。
鉄は磁石につきますが、硫化鉄はつきません。
鉄に塩酸を加えると水素が発生し、硫化鉄に塩酸を加えると硫化水素が発生します。
硫化水素は、卵のくさったようなにおいのする有毒な気体で、においをかぐときは、手であおぐようにしてかぎます。
鉄と硫黄の化合は発熱反応で、反応で発生する熱で反応が次々と進みます。
・銅と硫黄の化合
銅+硫黄→硫化銅(Cu+S→CuS)
質量比は、Cu:S:CuS=2:1:3、です。
銅の色は赤色、硫黄の色は黄色、酸化銅の色は黒色です。
実験では、らせん状にした銅線を溶けた硫黄の中に入れます。
■酸化
ある物質が酸素と化合することを酸化といい、酸化によってできた物質を酸化物といいます。
酸化の例として、銅の酸化とマグネシウムの燃焼を押さえましょう。
・銅の酸化
銅+酸素→酸化銅(2Cu+O2→2CuO)
銅が過不足なくすべて反応したときの質量比は、Cu:O2:CuO=4:1:5、です。
赤色の銅が黒色の酸化銅に変化します(酸化銅や酸化銀は黒色)。
銅を加熱するとき、加熱前と加熱後の質量の差が、化合した酸素の質量となります。
実験中、よくかき混ぜて空気に十分に触れさせないと、未反応部分がでてきてしまいます。
化学反応式「2Cu+O2→2CuO」を見ると、銅原子(Cu)2個と酸素分子(O2)1個つまり酸素原子(O)2個が化合しているので、
銅原子(Cu)の数と酸素原子(O)の数の比は、2:2=1:1より、
質量比「Cu:O2=4:1」は、銅原子(Cu)と酸素原子(O)の質量比でもあります。
・マグネシウムの燃焼
マグネシウム+酸素→酸化マグネシウム(2Mg+O2→2MgO)
マグネシウムが過不足なくすべて反応したときの質量比は、Mg:O2:MgO=3:2:5、です。
酸化には、空気中で金属がさびるようなゆるやかな酸化と、光や熱を出すような激しい酸化(燃焼)があります。
銀白色のマグネシウムが燃焼すると、白色の酸化マグネシウムに変化します(酸化マグネシウムや酸化アルミニウムは白色)。
燃焼前のマグネシウムはうすい塩酸と反応して水素が発生しますが、燃焼後の酸化マグネシウムは気体が発生しません。
化学反応式「2Mg+O2→2MgO」を見ると、マグネシウム原子(Mg)2個と酸素分子(O2)1個つまり酸素原子(O)2個が化合しているので、
マグネシウム原子(Mg)の数と酸素原子(O)の数の比は、2:2=1:1より、
質量比「Mg:O2=3:2」は、マグネシウム原子(Mg)と酸素原子(O)の質量比でもあります。
・化学カイロ
化学カイロの本質は、鉄の酸化です。
鉄の酸化の化学反応式は、
鉄+酸素→酸化鉄
銀白色の鉄が酸化(酸素と化合)して、黒色の酸化鉄となります。
酸化鉄は鉄と酸素と化合してできた化合物なので、化合した酸素の質量分だけ、鉄より質量が大きくなります。
また、鉄が酸化は発熱反応で、熱を放出します。だから化学「カイロ」です。
化学カイロには、活性炭と食塩水が含まれています。
活性炭は酸素を吸着するはたらきがあるので、鉄に酸素をたくさん供給する役割をなします。
食塩水(塩水)に鉄をつけるとさびます。さびるとは、ゆるやかな酸化反応が起こるということです。つまり、食塩水は鉄の酸化を促進する役割をなします。
問3
解答:10.5g
解説:
鉄と硫黄の化合の化学反応式は、以下の通りです。
Fe+S→FeS
質量比は、Fe:S:FeS=7:4:11、です。
これは、鉄と硫黄が過不足すべて反応した場合、質量比がFe:S:FeS=7:4:11、になるという意味です。
以上の知識をもとに、問題を解きます。
この問題では、鉄と硫黄が過不足すべて反応して、16.5gのFeSが発生しています。
16.5は11の1.5倍です(16.5/11)。
これより、
Fe:S:FeS=7:4:11=7×1.5:4×1.5:11×1.5=10.5:6:16.5
となり、10.5gの鉄と6.0gの硫黄が過不足すべて反応して、16.5gの硫化鉄が発生しています。
問4
解答:空気がなく、鉄粉と酸素が結びつかない
解説:
化学カイロの問題です。
化学カイロの本質は、鉄の酸化です。
鉄の酸化の化学反応式は、
鉄+酸素→酸化鉄
銀白色の鉄が酸化(酸素と化合)して、黒色の酸化鉄となります。
酸化鉄は鉄と酸素と化合してできた化合物なので、化合した酸素の質量分だけ、鉄より質量が大きくなります。
また、鉄が酸化は発熱反応で、熱を放出します。だから化学「カイロ」です。
化学カイロには、活性炭と食塩水が含まれています。
活性炭は酸素を吸着するはたらきがあるので、鉄に酸素をたくさん供給する役割をなします。
食塩水(塩水)に鉄をつけるとさびます。さびるとは、ゆるやかな酸化反応が起こるということです。つまり、食塩水は鉄の酸化を促進する役割をなします。
以上の知識をもとに、問題を解きます。
チャック付袋でフタをすると、酸素がシャットアウトされ、鉄が酸化せず、熱が発生しないので、温度があまり上昇しません。
大問4

問1
解答:
解説:
回路の作図の問題です。
回路とは、電流が電源装置の+極から出て−極にもどるひと回りの道のことです。
抵抗に電圧を加えると電流が流れます。
電圧→電流、という流れです。
抵抗とは、電流の流れにくさを表します。
金属線は抵抗が小さい材料で、このまま電圧を加えると、回路に大きな電流が流れてしまい危険です。
そこで、抵抗が大きい抵抗器や電熱線や豆電球などを接続して、回路に大きな電流が流れないようにします。
電流は+の電気で、電源装置の+極から出て、-極に戻るかたちで回路を流れます。
回路に流れる電流の大きさを測定する装置を電流計、
回路に加わる電圧の大きさを測定する装置を電圧計といいます。
電流計も電圧計も、+端子は電源の+極側に、−端子はまず3つの−端子のうち最大のものにつなぎます。
測定部分に対し、電流計は直列に、電圧計は並列に接続します。
以上の知識をもとに、問題を解きます。
まず、電源装置の+極と電流計の+端子をつなぎ、次に、電流計の−端子と豆電球(抵抗)の右側をつなぎ、豆電球の左側と電極の右側をつなぎ、電極の左側と電源装置の−極をつないで、回路ができあがります。
問2
解答:非電解質
解説:
水に溶かすとイオンに分かれる(電離する)物質を電解質といいます。
水に溶かしてもイオンに分かれず、粒子(分子)として水溶液中に拡散するだけの物質を非電解質といいます。
水中にイオンがあるので、電解質を溶かした水溶液(電解質の水溶液)は、電気(電流)を通します。
電解質として、酸、アルカリ、食塩、塩化銅などがあります。
非電解質として、砂糖とエタノールがあります。非電解質は砂糖とエタノールであることは、必ず覚えましょう。
問3
解答:蒸留水で洗う。
解説:
解答の通りです。
問4
解答: 物質名:塩化水素、化学式:HCl
解説:
気体の塩化水素が水に溶けた水溶液を、塩酸(化学式:HCl)といいます。
塩化水素は、無色・刺激臭がある有毒な気体で、水によくとけます。
塩化水素をアンモニア水に入れると、白煙が生じます。
大問5
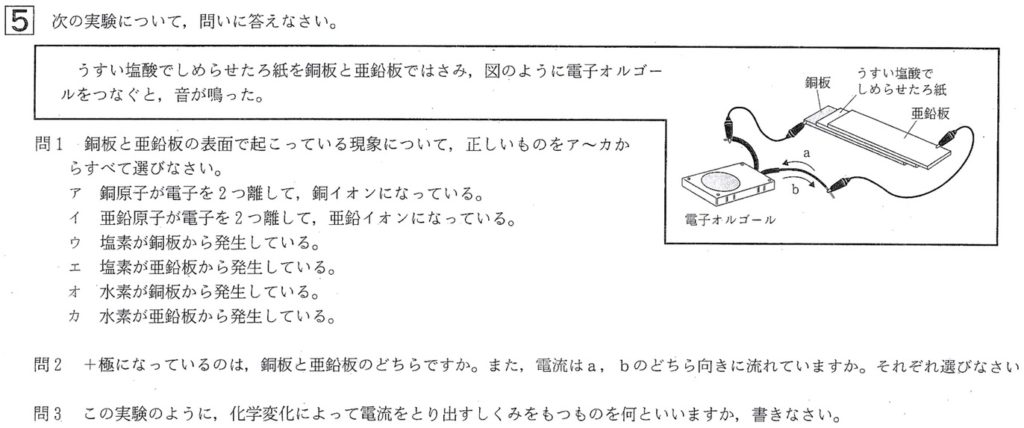
問1
解答:イ、オ(カ)
解説:
銅(Cu)やマグネシウム(Mg)は、1粒の金属原子で全体を代表します。
金属原子は、電解質の水溶液中で溶けて電子を放出して、陽イオンになる性質があります。
この陽イオンへのなりやすさをイオン化傾向といい、金属によって異なります。
主な金属のイオン化傾向は、以下の通りです。
Mg>Al>Zn>Fe>(H)>Cu>Ag
※水素は金属ではありませんが、陽イオンへのなりやすさを比較するよい目安となるため、入れられます。
金属のイオン化傾向の違いを利用して、化学電池を作ることができます。
電池の本質は、電流が流れることです。
電子の向きと電流の向きは逆の関係があることを押さえてください。
以上の知識をもとに、問題を解きます。
この実験では、電解質の水溶液としてうすい塩酸(HCl)を、金属として亜鉛板と銅板を用いています。
塩酸は気体の塩化水素が水にとけたもので、水溶液では、以下のように電離します。
HCl→H++Cl–
亜鉛(Zn)と銅(Cu)では、亜鉛の方がイオン化傾向が大きいので、亜鉛原子がうすい塩酸に溶けて電子を2コ放出し、
電子が銅板にいき、H+2コが電子を受け取り水素(H2)が発生します。
電子が亜鉛板から銅板に移動することで、電流は銅板から亜鉛板に流れます。
電流は+の電気です。
+どうし-どうしは反発し、+と-はくっつきます。
これより、亜鉛板が陰極(-極)、銅板が陽極(+極)となります。
銅は+極→十円玉、と覚えましょう。
亜鉛板での反応は、Zn→Zn+2e–
銅板での反応は、2H++2e–→H2
となります。
また、亜鉛にうすい塩酸を加えると水素が発生するので、亜鉛板の表面がうすい塩酸にとけて、水素が少しだけ発生しています。
問2
解答: +極:銅板、電極:b
解説:
銅は+極→十円玉、と覚えましょう。
+どうし-どうしは反発し、+と-はくっつきます。
電流は+の電気で、電源装置の+極から出て、-極に戻るかたちで回路を流れます。
問3
解答:化学電池
解説:
問1解説参照。
大問6
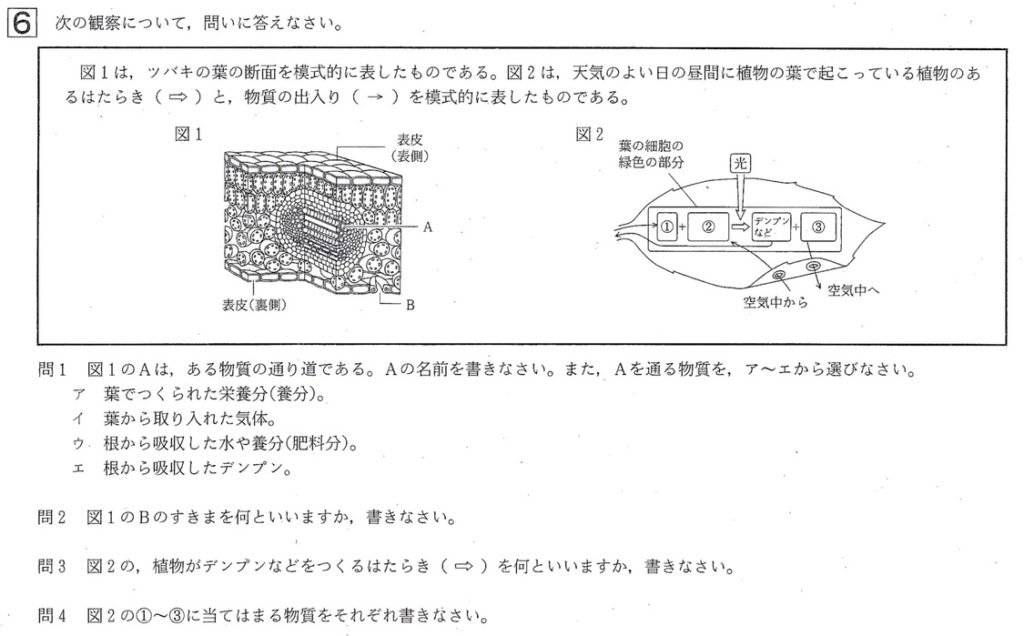
問1
解答: A:道管、通る物質:ウ
解説:
根で吸収された水は、茎の道管→葉の維管束である葉脈の道管→葉に送り届けられ、光合成の材料として使われます。
維管束とは、道管と師管の束のことです。
道管は、根から吸収された水や肥料分が通る管で、茎では維管束の内側にあります。
師管は、葉で光合成で作られた養分(デンプン→ショ糖)が通る管で、茎では維管束の外側にあります。
葉の断面図においては、上から、表皮、柵状組織、維管束である葉脈、海綿状組織、表皮(裏側、気孔が多くある)、からなります。
植物の葉には葉緑体があり、光合成は葉緑体で行われます。
葉緑体は、柵状組織、海綿状組織、葉の裏側の孔辺細胞(孔辺細胞のすきまが気孔)にあります。
葉は光を受けやすく、光合成がさかんなため、柵状組織がぎっしりならびます。裏は気孔(B)が多く、気体(酸素と二酸化炭素)が出入りしやすいように、海綿状組織がまばらに並びます。
葉の維管束を葉脈といいます。
茎の維管束では、内側が道管で外側が師管ですが、葉の維管束では、上側(表皮側)が道管(A)で下側が師管です。
光合成は葉緑体で行われます。
根で吸収した水が茎の道管(維管束の内側)から葉の維管束である葉脈(維管束の上側)を通り葉緑体に届けられ、
孔辺細胞の隙間である気孔で吸収された二酸化炭素を日光(光エネルギー)を用いて、単糖類であるグルコース(ブドウ糖)と酸素に合成されます。
グルコースは水に溶けやすく、このままの形では葉に栄養分を貯蔵できないため、グルコースが多数つながった水に溶けにくいデンプンにつくり変えられます。
夜間に水に溶けやすい二糖類のスクロース(ショ糖)に変えられ、師管を通ってからだの各部へ運ばれて、呼吸や成長の材料として使われます。
問2
解答:気孔
解説:
植物の葉の表、葉の裏、茎には気孔(孔辺細胞の隙間)があり、気孔から酸素や二酸化炭素が出入りし、水蒸気が出て行きます。
植物は光合成と呼吸を同時に行います。
光合成では、葉の気孔から、二酸化炭素が入り酸素が出ます。
呼吸では、葉の気孔から、酸素が入り二酸化炭素が出ます。
光の当たる場所では、光合成のはたらきの方が強くなるので、光合成で出入りする気体の量が、呼吸で出入りする気体の量より多くなり、あたかも酸素が放出されているかのように見えます。
光の当たらない場所では、呼吸のみ行われるので、二酸化炭素のみ放出されます。
植物体内の水が、気孔から水蒸気となって体外に放出される現象を蒸散といいます。
蒸散がもつ3つのはたらき(メリット)は、
①体内の水分量の調節
②植物体の温度調節
→蒸散が起こると気化熱により植物体の温度が下がる
③水分移動の促進
→葉で蒸散が起こると植物体の水分量が減り、葉の細胞内液の濃度が高くなり、根から道管に水を押し上げる力である根圧と、葉が道管から水を吸収しようとする力である吸水力により、水分移動が促進される
問3
解答:光合成
解説:
光合成は葉緑体で行われます。
根で吸収した水が茎の道管(維管束の内側)から葉の維管束である葉脈(維管束の上側)を通り葉緑体に届けられ、
孔辺細胞の隙間である気孔で吸収された二酸化炭素を日光(光エネルギー)を用いて、単糖類であるグルコース(ブドウ糖)と酸素に合成されます。
グルコースは水に溶けやすく、このままの形では葉に栄養分を貯蔵できないため、グルコースが多数つながった水に溶けにくいデンプンにつくり変えられます。
エネルギーは移り変わります。
光合成では、水と二酸化炭素が日光(光エネルギー)により、酸素とデンプンになります。
光エネルギーを受ける化学反応であるので、化学エネルギーが高い状態となります。
呼吸は、酸素と糖が分解され、生命活動の元として利用されるエネルギーが放出され、分解された糖は(有機物)は二酸化炭素と水になります。
この生命活動の元として利用されるエネルギーは、光合成で得た光エネルギーです。
呼吸ではエネルギーが放出されているので、二酸化炭素と水がもつ化学エネルギーは、酸素と糖より低くなります。
呼吸と光合成は、逆の関係にあるといえます。
問4
解答: ①水、②二酸化炭素、③酸素
解説:
問1解説参照。
大問7

問1
解答:エ
解説:
地球は、地殻(大陸部:5〜60㎞、海洋部:5〜10㎞)→マントル→外核→内核でできています。
地球の表層部(地殻とマントルの上部の一部)は、厚さ100kmくらいの固い岩盤で覆われており、この岩盤をプレートといいます。
日本の東北以北では、海洋プレートである太平洋プレートと、日本列島の下にある大陸プレートである北アメリカプレートがあります。
プレートは、年数cmというゆっくりとした速度で、決まった方向に動いています。
海洋プレートは大陸プレートよりも密度が大きいため、太平洋側の海洋プレートが、大陸プレートの下に沈み込むようにしてぶつかり合っています。
両者のプレートどうしの摩擦や圧力で、岩石の一部が溶けて、マグマが発生します。
マグマは地殻より密度が小さいため、上昇し、地殻にマグマだまりを形成します。
マグマが冷えると、ガスと鉱物に分離して、膨張して体積が大きくなり、地殻内部の圧力が強くなります。
やがて、地殻の弱い部分を破り、噴火が起こります。
マグマが冷えて固まってできた岩石を、火成岩といいます。
火成岩は、火山岩と深成岩に分けられます。
火山岩は、マグマが地表や地表付近で急に冷えて固まった岩石です。
そのため、非常に細かな結晶やガラスからなる石基と、石基の中に散らばって見える大きな結晶である斑晶からなる、斑状組織をしています(岩石Q)。
深成岩は、マグマが地下深くでゆっくり冷えて固まった岩石です。
そのため、結晶が大きく成長してできる、等粒状組織をしています(岩石P)。
斑状組織や等粒状組織になる理由は、ミョウバンの水溶液実験で分かります。
60℃におけるミョウバンの飽和水溶液AとBをつくり、Aはぬるま湯で、Bは氷水で冷やすと、Aは大きな結晶、Bは細かい結晶ができます。
問2
解答: P:等粒状組織、Q:斑状組織
解説:
問1解説参照。
問3
解答: 鉱物:イ、岩石:花こう岩
解説:
火成岩(火山岩と深成岩)は、いくつかの鉱物が集まってできています。
火成岩などの岩石をつくっている鉱物を造岩鉱物といい、白または透明の無色鉱物と、有色鉱物に分けられます。
無色鉱物として、セキエイとチョウ石があります。
セキエイは不規則に割れ、チョウ石は規則的に割れます。
有色鉱物として、クロウンモ・カクセン石・キ石・カンラン石・磁鉄鉱があります。
クロウンモは規則的に割れ、磁鉄鉱は磁石につきます。
深成岩には、無色鉱物の割合が多い順に、花こう岩・せん緑岩・斑れい岩があります。
火山岩には、無色鉱物の割合が多い順に、流紋岩・安山岩・玄武岩があります。
無色鉱物の割合が多いほど、二酸化ケイ素(白色の化合物)の割合も多くなります。
二酸化ケイ素の割合が多いと、岩石は白っぽく、マグマの温度が低いため粘り気が強く、冷えて固まる際にガスが抜けにくく、爆発的噴火をします。
そのため、火山は溶岩ドームとなります。溶岩ドームとして、昭和新山・有珠山・雲仙普賢岳を覚えましょう。
無色鉱物の割合が少ないと、二酸化ケイ素の割合も少なくなります。
二酸化ケイ素の割合が少ないと、岩石は黒っぽく、温度が高いためマグマの粘り気が弱く、冷えて固まる際にガスがやすくく、静かに溶岩を流出する噴火をします。
そのため、火山の形は盾状火山となります。盾状火山として、マウナロアとキラウエアを覚えましょう。
マグマの粘り気が中間のとき、火山の形は成層火山となります。成層火山として、桜島・浅間山・富士山・男体山・三原山を覚えましょう。
以上の知識をもとに、問題を解きます。
岩石Pは等粒状組織をしているので、深成岩です。
深成岩には、無色鉱物の割合が多い順に、花こう岩・せん緑岩・斑れい岩があります。
岩石Pは全体的に白っぽいことから、無色鉱物の割合が多い花こう岩です。
深成岩である岩石Pに含まれる鉱物①は、無色で不規則に割れる鉱物なので、鉱物①はセキエイです。
また岩石Pに含まれる鉱物②は、黒色でうすくはがれる鉱物なので、鉱物②はクロウンモです。
問4
解答:エ
解説:
岩石Qは斑状組織をしているので、火山岩です。
火山岩には、無色鉱物の割合が多い順に、流紋岩・安山岩・玄武岩があります。
岩石Qは全体的に黒っぽいことから、無色鉱物の割合が少ない岩石である玄武岩であると考えられます。
無色鉱物の割合が少ないと、二酸化ケイ素の割合も少なくなります。
二酸化ケイ素の割合が少ないと、岩石は黒っぽく、温度が高いためマグマの粘り気が弱く、冷えて固まる際にガスがやすくく、静かに溶岩を流出する噴火をします。
そのため、火山の形は盾状火山となります。盾状火山として、マウナロアとキラウエアを覚えましょう。
大問8
問1
解答:示準化石
解説:
岩石は、風化によってもろくなり、流水の3作用(浸食・運搬・堆積)により、れき・砂・泥として河口に運ばれ堆積します。
堆積したれき・砂・泥が盾状に積み重なったものを地層といいます。
地層をつくる押し固められた岩石を、堆積岩といいます。
堆積岩は、①粒の大きさ、②成分で分類できます。
①粒の大きさ
・粒の直径が2mm以上:れき岩(泥や砂で固められた岩石)
・粒の直径が2〜1/16mm:砂岩
・粒の直径が1/16mm以下:泥岩
②成分
・石灰岩:貝・サンゴ・フズリナの遺がいなど石灰質(炭酸カルシウム)の堆積物
サンゴの化石があることで、地層があった地域があたたかくて浅い海だったことが分かります。このような化石を示相化石といいます。
フズリナの化石があることで、地層が堆積した年代が古生代であったことが分かります。このような化石を示準化石といいます。
石灰岩はうすい塩酸と反応して二酸化炭素が発生します。
・チャート:ホウサンチュウ・ケイソウなどの遺がいなどケイ酸質(二酸化ケイ素)の堆積物
チャートは深海ででき、二酸化ケイ素でできた鉱物のセキエイと同様、非常にかたいです。
チャートにうすい塩酸を加えても、二酸化炭素は発生しません。
・凝灰岩:火山灰や軽石などが堆積したもの
堆積岩は流水の働きなどにより削られるため粒が丸いですが、火成岩の粒は角張っています。
同様に、火山噴出物である火山灰などでできた凝灰岩の粒は、他の堆積岩とは違い、角張っています。
以上の知識をもとに、問題を解きます。
地層にアンモナイトがあると、中生代に堆積した地層であることが分かるので、アンモナイトは示準化石です。
示準化石となるには、①短い期間に栄えて絶滅した、②世界の広範囲で発見されている必要がある、の2つが必要です。
問2
解答:(古)2→3→1(新)
解説:
地層の読み方のひとつとして、地層累重の法則があります。
地層累重の法則とは、地層がひと続きに連続した地層は、上にあるほど新しいという法則です。
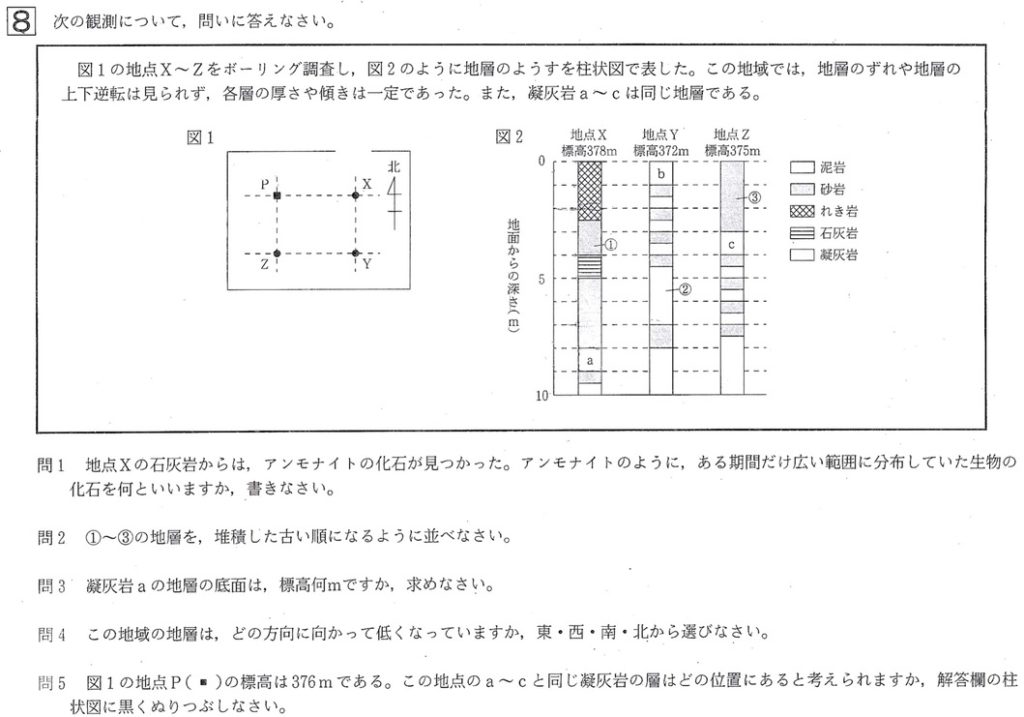
問題文に「この地域では、地層のずれや地層の上下逆転は見られず、各層の厚さや傾きは一定であった」とあるので、地層累重の法則を用いて考えてきます。
問題文に「また、凝灰岩a〜cは同じ地層である」とあるので、地点Xの凝灰岩aと地点Yの凝灰岩bと地点Zの凝灰岩cをつなげます。
すると、地層①〜③は、2→3→1の順に堆積していったことが分かります。
問3
解答:369m
解説:
地点Xの凝灰岩aの下面は地表から9m下にあるので、地点Xの凝灰岩aの上面の標高は、378m – 9m=369m、です。
問4
解答:北
解説:
地層の標高を求めるとき、各地点の地層に共通するかぎ層の上部あるいは下面の標高を求めていきます。
かぎ層として、凝灰岩の層がよく用いられます。
地点Xの凝灰岩aの上面は地表から8m下にあるので、地点Xの凝灰岩aの上面の標高は、378m – 8m=370m、です。
地点Yの凝灰岩bの上面は地表にあるので、地点Yの凝灰岩bの上面の標高は、372m – 0m=372m、です。
地点Zの凝灰岩cの上面は地表から3m下にあるので、地点Zの凝灰岩cの上面の標高は、375m – 3m=372m、です。
地点Yと地点Zの凝灰岩の上面の標高が372mと等しく、北にある地点Xの凝灰岩の上面の標高が370mと低くなっていることから、
凝灰岩の層までは、地点Xの標高が低いので、北に向かって低くなっていることが分かります。
凝灰岩の層以降は、様々な層が堆積して、地点Xの標高が最も高くなっています。
また、地点Yと地点Zの凝灰岩の上面の標高が372mと等しいことから、凝灰岩の層までは、東西方向に水平であることも分かります。
問5
解答:
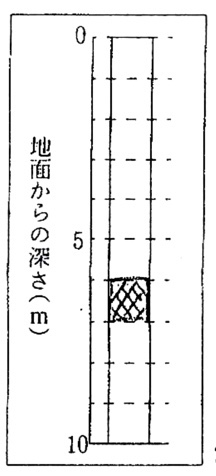
解説:
地点Yと地点Zの凝灰岩の上面の標高が372mと等しいことから、凝灰岩の層までは、東西方向に水平です。
地点Pは凝灰岩の上面の標高が地点Xと同じなので、凝灰岩の上面の標高は370mです。
地点Pの標高は376mより、凝灰岩の上面は地表から6m下にあります。
問題文に「各層の厚さや傾きは一定であった」とあるので、凝灰岩の層の厚さは凝灰岩a〜cの層と同じ1mです。
以上より、答えが得られます。
大問9

問1
解答:イ
解説:
気体の水を水蒸気といいます。
湯気(水蒸気が冷えてできた水の粒)は見えますが、水蒸気は見えません。
空気は水蒸気を含むことができる入れ物とみなせます。
空気が水蒸気をどのくらい含むことができるのかを表す尺度として、1辺が1m・体積1m3の立方体の空気中に含まれている水蒸気量(g)、単位[g/m3]を用います。
空気は温度が上がると、水蒸気をより多く含むことができます。
空気に含まれる水蒸気が最大になっている状態を、水蒸気で飽和しているといい、空気1m3が含むことができる最大の水蒸気量を、飽和水蒸気量といいます。
温度と飽和水蒸気量の関係を表したグラフが、飽和水蒸気量曲線です。
ある温度の空気において、飽和水蒸気量に対する含まれている水蒸気量の割合を湿度といいます。
湿度は、以下の式で表すことができます。
湿度(%)=水蒸気量[g/m3]/飽和水蒸気量[g/m3]×100
この湿度の式は、飽和水蒸気量が分かっている場合に使える式です。
湿度はこのほかに、乾湿計を用いて調べることもできます。
乾湿計とは、乾球と湿球を組み合わせて、気温と湿度を測定する装置のことです。
乾球の示度は通常の温度計と同じで、気温を示します。
これに対して湿球は、ぬれたガーゼから水分が蒸発し、そのときまわりから気化熱を奪うため、示度(温度)は常に乾球以下になります。
乾球の示度および湿球の示度の差から、与えられた湿度表を用いて、湿度を求めることができます。
なお、湿球の示度が乾球の示度と等しくなるとき、ぬれたガーゼから水分が蒸発していない、つまり空気がこれ以上水蒸気を含むことができない状態なので、湿度は100%です。
以上の知識をもとに、問題を解きます。
・ア
気温が同じ場合、つまり乾球の示度が同じ場合、乾球と湿球の示度の差が大きいと、湿球のぬれたガーゼが気化熱をたくさん奪っていることになり、空気中の水蒸気量が少ないことを意味します。
湿度の公式より、気温が同じ場合、つまり飽和水蒸気量が同じ場合、空気中の水蒸気量が少ないと湿度は低くなります。
・イ
乾球と湿球の示度の差が同じとき、表2をタテに見ると、気温=乾球の示度が低いと湿度が低くなっていることが分かります。
・ウ
選択肢イと同じ考え方をすると、正しいことが分かります。
・エ
湿球の示度が乾球の示度と等しくなるとき、ぬれたガーゼから水分が蒸発していない、つまり空気がこれ以上水蒸気を含むことができない状態なので、湿度は100%です。
問2
解答:14時
解説:
湿度をひとつひとつ地道に調べていきます。
表1と表2より、8時の湿度は81%、10時の湿度は74%、12時の湿度は60%、14時の湿度は83%より、14時の湿度が最も高いです。
問3
解答:13.1g
解説:
湿度の公式を変形して解きます。
湿度(%)=水蒸気量[g/m3]/飽和水蒸気量[g/m3]×100 ⇔ 水蒸気量[g/m3]=湿度(%)×飽和水蒸気量[g/m3]/100
表1と表2より、12時の湿度は60%です。
表1より、12時の乾球の示度=気温は24℃です。表3より、24℃の飽和水蒸気量は21.8g/m3です。
よって、水蒸気量[g/m3]は、
水蒸気量[g/m3]=湿度(%)×飽和水蒸気量[g/m3]/100 =60×21.8/100=3×21.8/5=3×4.36=13.08≒13.1g/m3
大問10

問1
解答:ウ
解説:
空気の成分比率は、体積の割合で多い順から
窒素(約78%)、酸素(約21%)、アルゴン(約0.9%)、二酸化炭素(約0.04%)です。
このほか、ネオン、ヘリウムなども微量ですが含まれています。
これらの気体分子(粒子)は、空気中を盛んに動いており、地面などに衝突して圧力(気圧)が生じます。
地面が太陽熱などで暖められると空気は上昇し、それと比較して冷たい場所に空気が流れ、空気が下降します。
空気が上昇すると、その場所では空気を構成する粒子の数が減るため、気圧が減少し、低気圧となります。
空気が下降すると、その場所では空気を構成する粒子が押されて数が増えるため、気圧が上昇し、高気圧となります。
空気は、冷たい方から温かい方に水平に流れます。
地球の地上10kmまでを対流圏といい、対流がさかんに起こっています。
対流のうち、水平方向の動きを風、垂直方向の動きを気流といいます。
暖かい場所では上昇気流が生じて低気圧となり、上昇した空気は冷たい方に流れ(風)、冷たい場所では下降気流が生じて高気圧となり、地表面では、暖かい場所(低気圧)から冷たい場所(高気圧)に向かって流れます(風)。
地球では、自転速度の差によって生じる右向きの力であるコリオリの力が発生するので、北半球の風向は、等圧線に対して垂直な方向よりも右にそれて吹きます。
そのため、低気圧では反時計回りに風が吹き込み、高気圧では時計回りに風が吹き出します。
北半球では、北緯30〜60度付近で吹く西寄りの風である偏西風が吹くので、低気圧は東から西に流れます。
低気圧が流れることで、暖気と寒気(緯度が上がると冷える)が触れ、寒冷前線と温暖前線が生じます。
この前線をともなう低気圧のことを、温帯低気圧といいます。
偏西風により低気圧は東から西に流れ、コリオリの力により風は低気圧に反時計回りに吹き込むことで、
温帯低気圧の左側で寒冷前線が、温帯低気圧の右側で温暖前線が生じます。
前線が通過する順番は、温暖前線→寒冷前線の順です。
温暖前線を正面から見ると、密度が小さく軽い暖気が密度が高く重たい寒気の上にはいあがり、寒気を後退させながら進みます。
このため緩やかな上昇気流が生じ、前線(暖気と寒気の境目である前線面と地面との接点)から右に向かって乱層雲・高層雲・巻層雲・巻雲などの層状の雲が生じ、乱層雲により広い範囲(前線から200〜300km)に長い時間、弱い雨を降らせます。
通過後は、暖気におおわれるため気温が上がり、風向が南よりに変わります。
寒冷前線を正面から見ると、密度が高く重たい寒気が密度が低く軽い暖気の下にもぐり込み、暖気を垂直方向に押し上げながら進みます。
このため激しい上昇気流が生じ、前線から左に向かって積乱雲や積雲などが生じ、積乱雲により狭い範囲(前線から50〜60km)に短時間で強い雨が降らせます。
通過後は、寒気に覆われるため気温が下がり、風向が南よりから北よりに急変します。
以上の知識をもとに、問題を解きます。
A地点には、温暖前線が近づいています。
温暖前線が近づくと、巻雲→巻層雲→高層雲→乱層雲の順で雲が近づいてきます。
乱層雲により広い範囲(前線から200〜300km)に長い時間、弱い雨が降ります。
問2
解答: ①:ゆるやか、②:暖気、③:上がる
解説:
前線OPは、温暖前線です。
温暖前線を正面から見ると、密度が小さく軽い暖気が密度が高く重たい寒気の上にはいあがり、寒気を後退させながら進みます。
このため緩やかな上昇気流が生じ、前線(暖気と寒気の境目である前線面と地面との接点)から右に向かって乱層雲・高層雲・巻層雲・巻雲などの層状の雲が生じ、乱層雲により広い範囲(前線から200〜300km)に長い時間、弱い雨を降らせます。
通過後は、暖気におおわれるため気温が上がり、風向が南よりに変わります。
問3
解答:ア
解説:
前線OQは、寒冷前線です。
寒冷前線を正面から見ると、密度が高く重たい寒気が密度が低く軽い暖気の下にもぐり込み、暖気を垂直方向に押し上げながら進みます。
このため激しい上昇気流が生じ、前線から左に向かって積乱雲や積雲などが生じ、積乱雲により狭い範囲(前線から50〜60km)に短時間で強い雨が降らせます。
通過後は、寒気に覆われるため気温が下がり、風向が南よりから北よりに急変します。
低気圧はコリオリの力により、低気圧では反時計回りに風が吹き込みます。
そのため、B地点では南西の風が吹いていますが、寒冷前線通過後は、北西の風が吹きます。
大問11
問1
解答:1、2
解説:
植物の分類の観点はまず、種子をつくるか否かで大別します。
種子を作る植物を種子植物といいます。
種子植物はさらに、胚珠が子房に包まれているか否かで分類し、胚珠が子房に包まれている植物を被子植物、胚珠がむきだしの植物を裸子植物といいます。
被子植物はさらに、子葉の枚数で分類し、子葉が1枚の植物を単子葉類、子葉が2枚の植物を双子葉類といいます。
双子葉類は、子葉が2枚、葉脈(葉の維管束)が網状脈、茎の維管束が輪状に並びます。
維管束とは、道管と師管の束のことです。
道管は、根から吸収された水や肥料分が通る管で、茎では維管束の内側にあります。
師管は、葉で光合成で作られた養分(デンプン→ショ糖)が通る管で、茎では維管束の外側にあります。
双子葉類の根は、主根と側根からなり、根の先端ちかくに根毛があり、表面積を広げる構造をしており、これにより水や肥料分を効率よく吸収できます。
単子葉類は、子葉が1枚、葉脈(葉の維管束)が平行脈、茎の維管束が全体に散らばっています。
双子葉類と同じく、道管は維管束の内側に、師管は維管束の外側にあります。
単子葉類の根はひげ根で、根の先端ちかくに根毛があり、表面積を広げる構造をしており、これにより水や肥料分を効率よく吸収できます。
双子葉類はさらに、花弁がくっついているか否かで分類し、花弁がくっついている植物を合弁花類(ツツジ)、花弁が離れている植物を離弁花類(アブラナ)といいます。
単子葉類として、イネ・トウモロコシ・スズメノカタビラ・ユリ・アヤメ・ツユクサ・チューリップを、
合弁花類として、ツツジ・タンポポ・アサガオを、
離弁花類として、サクラ・アブラナ・エンドウを、
裸子植物として、マツ、スギ、ヒノキ、イチョウ、ソテツを
それぞれ覚えましょう。
これに加えて、ホウセンカは双子葉類であることも覚えましょう。
種子を作らず、胞子で増える植物は、今度は維管束があるかどうか、または、根・茎・葉の区別かあるかどうかで大別され、
維管束がある植物をシダ植物、ない植物をコケ植物といいます。
シダ植物として、イヌワラビ・ゼンマイ・スギナを、
コケ植物として、スギゴケ・ゼニゴケを、
それぞれ覚えましょう。
問2
解答:酢酸オルセイン
解説:
生命の基本単位は、細胞です。
細胞は、核と細胞質からなる原形質と、原形質以外の後形質とからなります。
核は、中に遺伝子をのせた染色体を持ちます。
染色体は、遺伝子の本体として働く物質であるDNAと、ヒストンというタンパク質からなる糸状の構造物で、染色液によく染まることから、染色体と名が付けられています。
(染色体の”染色”の名の由来)
染色液として、以下の3種類を覚えましょう。
・酢酸カーミン溶液(赤色に染まる)
・酢酸オルセイン溶液(赤紫色に染まる)
・酢酸ダーリア溶液(青紫色に染まる)
細胞の細胞質の中には、核、細胞膜、葉緑体、液胞、ミトコンドリア、ゴルジ体、中心体などがあります。
・細胞膜:細胞内外を区切るとともに、物質の出入りを調節します。
・葉緑体:葉緑素(クロロフィル)を含み、光合成を行います。
・液胞:細胞中の水分量の調節や糖・無機塩類・不要物などを蓄積します。
・ミトコンドリア:細胞呼吸が行われる場所です。細胞は、生命活動に必要なエネルギーを得るために、ブドウ糖などの有機物を酸素を用いて分解する、呼吸を行っています。この細胞の呼吸を、肺などの呼吸器での呼吸(外呼吸)に対して、内呼吸といいます。
・ゴルジ体:おもに動物細胞にあり、細胞の分泌活動(物質を生産し、細胞外に出す働き)に関係しています。ゴルジ体は、とくに消化腺で発達しています。
・中心体:おもに動物細胞の核の近くにあり、動物細胞が体細胞分裂・減数分裂するときに出る、紡錘体形成の中心として働きます。
細胞の後形質は、細胞壁です。細胞壁は、細胞内の保護と形の保持を行っています。
動物細胞には、核・核小体・細胞質・細胞膜・ミトコンドリア・ゴルジ体・中心体などがあります。
植物細胞には、核・核小体・細胞質・細胞膜・葉緑体・ミトコンドリア・液胞・細胞壁などがあります。
問3
解答:体細胞分裂
解説:
からだをつくる細胞が分裂する細胞分裂を、体細胞分裂といいます。
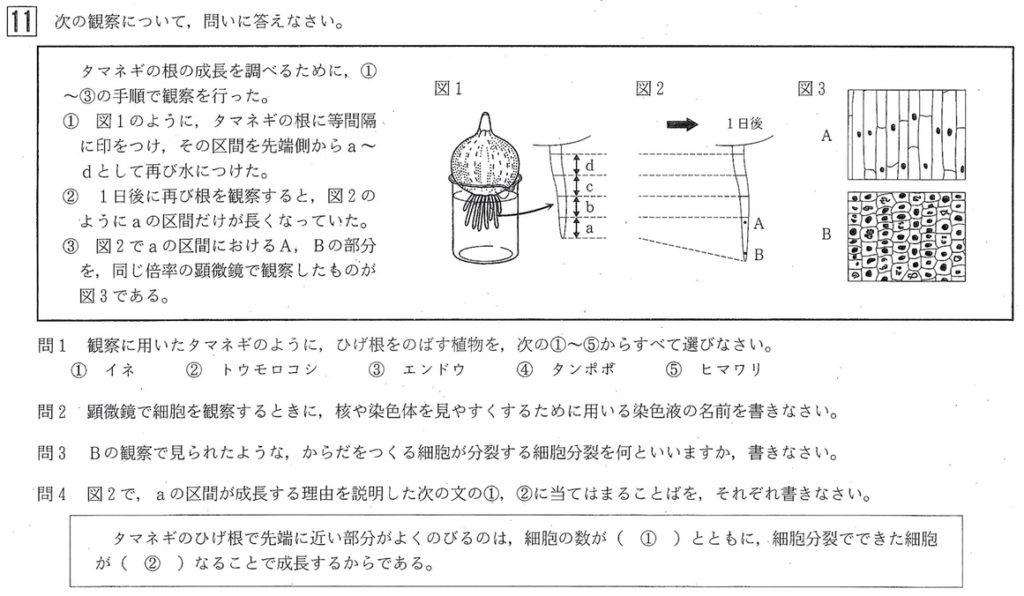
植物の根の成長は、2段階で進みます。
第一段階では、根端分裂組織(根の成長点)(B)でさかんに体細胞分裂が起こり、細胞の数を増やします。
第二段階では、分裂した細胞がもとの大きさくらいまで成長します(A)。
体細胞分裂の観察実験では、タマネギを用いて、以下の手順で行われます。
①体細胞分裂は根の先端付近でさかんに行われるので、タマネギの根の先端を5mmくらい切る
②(省略可能)酢酸で固定する。固定とは、細胞を生きていた状態に近いまま殺し、細胞内の構造・物質の分解を防ぐ方法です。
③塩酸で細胞どうしを離す。これを解離といい、細胞壁間の接着物質を溶かし、細胞どうしを離れやすくします。
④水洗する
⑤染色液で染色する。染色液に含まれる酢酸で固定できるので、手順②は省略可能。
⑥柄つき針を使って、カバーガラスをかける。気泡が入らないようにすること。
⑦ろ紙ではさんで軽く押しつぶす。細胞どうしの重なりをなくし観察しやすくするため。
問4
解答: ①:ふえる、②:大きく
解説:
問3解説参照。