👉教師紹介・料金
※授業料1回1,500円+交通費(コミコミ最大3,000円)・入会金なし・お好きな日時に受講・3回のお試し期間あり(無料教材あり)
■総合ABC範囲表
>>【最新版】総合ABC範囲表
■総合A過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年
■総合B過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年、2015年
■総合C過去問
科目別:国語、数学、社会、理科、英語
年度別:2024年、2023年、2022年、2021年、2020年、2019年、2018年、2017年、2016年、2015年
■総合ABC道コン偏差値
>>総合ABC道コン偏差値(SS)推移
☆過去問ダウンロードはこちら☆
※生徒以外で過去問のみをお求めの方は、こちらにご連絡ください(過去問の「原本」を頂ける方は歓迎します!)。
👉お問い合わせ
大門1
問1
答: うつった像:実像、向き:ウ
解説:
凸レンズとは、ガラス中央部分がまわりよりも厚いレンズのことです。
凸レンズの軸(光軸)に平行に入射した光がレンズで屈折して1カ所に集まる点を焦点(英語でfocusより、Fと書くことが多い)といいます。
点とみなせる光源から四方に出る光のうち、凸レンズに入射する光の進み方は、以下の4つです。
①光軸に平行に進む光線は焦点を通る
②レンズの中心を通る光線はそのまま直進
③焦点を通った光線は光軸に平行に進む
④それ以外の光線は、レンズまで直進し、レンズで屈折後、光の集合点に向かう。
像の作図は、①〜③のうちの2本を作図することでできます。
凸レンズを通った光が集まってできる像を、実像といいます。
このときに見える像は、スクリーン側から見ると、物体とは上下・左右が逆向きに見えるため、倒立実像といいます。
物体側から見た場合は、上下のみが逆の像が見えます。
光源とレンズ間の距離をa、焦点距離をfとおくと、
①a>2f(焦点距離の2倍):実物より小さい倒立実像
②a=2f:実物と同じ大きさの倒立実像
③f<a<2f:実物より大きい倒立実像。a=1.5fのとき、倒立実像の大きさは実物の2倍
④a=f:像ができない
⑤a<f(焦点の内側):実物より大きい正立虚像
以上の知識をもとに、問題を解きます。
スクリーンにうつった像は光が集まってできているので、実像です。
凸レンズ側から実像を見たとき、選択肢ウのように上下が逆の実像が、
スクリーン側から実像を見たとき、選択肢エのように上下左右が逆の倒立実像が見えます。
問2
答:小さくなる。
解説:
凸レンズと物体との距離と、凸レンズとスクリーンとの距離が等しいとき、三角形の合同の観点から、物体と倒立実像の大きさが等しくなります。
表より、凸レンズAとスクリーンとの距離が等しい距離は20cmなので、焦点距離はその半分の10cmです。
物体と凸レンズとの距離が30cmのとき、焦点距離の2倍である20cmより外側に物体があるので、実物より小さい倒立実像がスクリーンにうつります。
なお物体と凸レンズとの距離を大きくして、物体を凸レンズから遠ざけていくと、倒立実像は凸レンズに近づきながら小さくなっていきます。
逆に、物体と凸レンズとの距離を小さくして、物体を凸レンズへ近づけていくと、倒立実像は凸レンズから遠ざかりながら大きくなっていきます。
問3
答:15(cm)
解説:
凸レンズと物体との距離と、凸レンズとスクリーンとの距離が等しいとき、三角形の合同の観点から、物体と倒立実像の大きさが等しくなります。
表より、凸レンズAとスクリーンとの距離が等しい距離は30cmなので、焦点距離はその半分の15cmです。
問4
答:
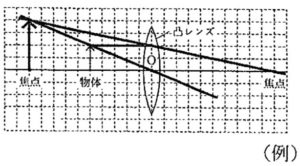
解説:
問2より、凸レンズAの焦点距離は10cmです。
物体と凸レンズAとの距離が5cmのとき、凸レンズAの焦点の内側にあるので、スクリーンに光が集まらず、凸レンズAを通じて物体より大きく、向きが物体と同じ正立虚像が見えます(虫めがねの原理)。
正立虚像の作図方法は、解答例を覚えましょう。
大門2

問1
答:純粋な水は、電流が流れないから。
解説:
水の電気分解の化学反応式は、以下の通りです。
水→水素+酸素(2H2O→2H2+O2)
しかし純粋な水(H2O)は分子をつくる物質で、このままでは電気(電流)が流れにくく、電気分解をすることができません。
そこで、電気(電流)を流しやすくするために、水酸化ナトリウム(NaOH)を少量加えます。
水酸化ナトリウムは、水に溶けると、ナトリウムイオン(Na+)と水酸化物イオン(OH–)に電離する、電解質の物質です。
水中にイオンがあると電気(電流)が流れるので、水に水酸化ナトリウムを加えると、電気(電流)が流れて、電気分解をすることができるようになります。
問2
答:水素
解説:
まず、「+どうし−どうしは反発するが、+と−はくっつく」ことを必ず押さえましょう
水の電気分解の化学反応式は、以下の通りです。
2H2O→2H2+O2
水素(H2)のイオンは水素イオン(H+)で、水素イオン(H+)は+に帯電しているので、−極(陰極)に引きつけられ、−極(陰極)から水素(H2)が発生します。
酸素(O2)のイオンは酸化物イオン(O2-)で、酸化物イオン(O2-)は−に帯電しているので、+極(陽極)に引きつけられ、+極(陽極)から酸素(O2)が発生します。
水の電気分解の化学反応式の、水素(H2)と酸素(O2)の係数の比は2:1より、水の電気分解により発生する水素(H2)と酸素(O2)の体積比は2:1となります。
水素(H2)は酸素(O2)の2倍発生します。
水素と酸素はともに水にとけにくい気体であるため、捕集できる量は、体積比と同じ2:1となります。
水素が発生したことの確認は、水素が可燃性をもつことを利用して、火のついたマッチを近づけると、「ポン」と音を立てて燃えることで分かります。。
代表的な気体の性質は、以下の通りです。
・酸素
酸素の性質として、以下の4つを押さえましょう。
①無色・無臭、②空気よりやや重い(空気の重さの約1.1倍)、③水にとけにくい、★④助燃性をもつ
このほかの気体の性質も、ここで押さえましょう。
・水素
水素の性質として、以下の4つを押さえましょう。
①無色・無臭、②最も軽い気体(空気の重さの約0.08倍)、③水にとけにくい、★④可燃性をもつ
水素は、亜鉛またはマグネシウムにうすい塩酸を加えると発生します。
また、水(H2O)や塩酸(HCl)を電気分解することでも発生します(水素イオンH+より、陰極で発生)
・二酸化炭素
二酸化炭素の性質として、以下の4つを押さえましょう。
①無色・無臭、★②空気より重い(空気の重さの約1.5倍)、③水に少しとける(H+を放出する酸より水溶液は酸性)、★④石灰水を白く濁らせる
・窒素
空気の約8割を占める窒素は、以下の5つの性質を持ちます。
①無色・無臭、②空気より少しだけ軽い、③水に溶けにくい、④助燃性(O2)・可燃性(H2)なし
★⑤常温では他の物質と結びついて化学変化を起こすことはほとんどない(この性質を利用した食品の酸化を防ぐ方法に、窒素充填がある)
・アンモニア
アンモニアの性質として、以下の4つを押さえましょう。
★①無色・刺激臭、★②空気より軽い、★③水に非常によく溶ける(20℃の水1cm3に702cm3溶ける)(OH–を放出するアルカリより水溶液はアルカリ性)→アンモニアの噴水実験、★④塩化水素と反応し、白煙(塩化アンモニウムの白色の固体)を生じる
問3
答:エ
解説:
問2解説参照。
問4
答:2H2O→2H2+O2
解説:
問2解説参照。
大門3

問1
答:試験管Aに酸素(空気)が入らないようにするため。
解説:
化学変化のうち、2種類以上の物質が結びついて、まったく別の新しい物質ができる変化を、化合といいます。
ある物質が酸素と化合することを酸化といい、酸化によってできた物質を酸化物といいます。
酸化の例として、銅の酸化があります。
・銅の酸化
銅+酸素→酸化銅(2Cu+O2→2CuO)
質量比は、Cu:O2:CuO=4:1:5
酸化物から何らかの方法で酸素を取り除くと、再びもとの物質に戻ります。
このように、酸化物から酸素を取り除く変化を還元といい、酸化物から酸素を取り除くはたらきをする物質を還元剤といいます。
還元剤として、水素や炭素などが用いられます。
還元の例として、以下の2つを押さえましょう。
・酸化銅の炭素による還元
酸化銅(黒色)+炭素→銅(赤色)+二酸化炭素(2CuO+C→2Cu+CO2)
・酸化銅の水素による還元
酸化銅(黒色)+水素→銅(赤色)+水
(CuO+H2→Cu+H2O)
ここで、例えば酸化銅を炭素で還元する反応では、酸化銅は還元されて銅になり、還元剤である炭素は酸化されて二酸化炭素になっています。
このように、還元反応が起こると同時に酸化反応が起こるので、反応における両者の側面をとらえて、酸化還元反応ということがあります。
酸化銅の炭素による還元の実験では、
実験によって、酸化銅が還元されて銅になります。
火を止めると試験管内部が冷えて気圧が下がり、下がった気圧を補うために外気を取り込みます。
もしこのときピンチコックを閉め忘れたなら、外気が取り入れられ、加熱された銅に酸素が化合して、銅が酸化されて酸化銅に戻ってしまいます。
問2
答:ア、ウ、エ
解説:
物質は有機物と無機物に大別され、無機物はさらに、金属と非金属に分類されます。
プラスチックの原料は、ほとんどが石油(ナフサ)です。
石油は有機物であるので炭素(C)と水素(H)を含んでおり、燃やす(酸素O2と化合する)と二酸化炭素(CO2)と水(H2O)が発生します。
プラスチックの性質として、以下の4つがあります。
①軽くてしなやか
②熱や油、薬品に強い
③耐水性、可塑性(変形した物体が元の形に戻らない性質)にすぐれている
④生分解性プラスチックは、土のなかで微生物により分解される
プラスチックの種類として、以下の5種類を押さえておきましょう。
・ポリエチレンテレフタレート(PET):燃えにくいが多少のすすがでる
・ポリエチレン(PE):溶けながらよく燃える、水に浮く
・ポリスチレン(PS):すすを出しながら燃える
・ポリプロピレン(PP):溶けながらよく燃える、水に浮く
・ポリ塩化ビニル(PVC):燃えにくい
ポリエチレン(PE)とポリプロピレン(PP)以外は、4℃の水(密度 1.0g/cm3)より密度が大きいため、水に沈みます。
金属には、すべての金属に共通する3つの性質があります。
①みがくと光る(金属光沢)
②たたくとのびたり、広がったりする(延性・展性)
③電気や熱を通す(電気伝導性・熱伝導性)
すべての金属に共通しない性質として、「磁石につく」があります。
磁石につくのは、鉄・ニッケル・コバルトです。
以上の知識をもとに、問題を解きます。
試験管Aに残った固体は銅です。
銅は金属なので、正解はア、ウ、エです。銅は磁石につかないことに注意です。
問3
答:
![]()
解説:
・酸化銅の炭素による還元
酸化銅(黒色)+炭素→銅(赤色)+二酸化炭素(2CuO+C→2Cu+CO2)
化学反応式を元にモデルを書いて終了です。
大門4
問1
答: X:銅、Y:塩素
解説:
塩化銅の電離式は以下のとおりです。
CuCl2→Cu2++2Cl–
プラスとマイナスはくっつくので、陽極(+極)で塩素(Cl2)が、陰極(-極)で銅(Cu)が発生します。
実験では、両極とも炭素棒を用いており、同種類の金属を用いていることから、電気分解の実験をしています。
塩化銅(CuCl2)の電気分解では、電離した銅イオン(Cu2+)が陰極に、塩化物イオン(Cl–)が陽極に引き寄せられます。
プラス(+)どうしマイナス(−)どうしは反発し、プラスとマイナスはくっつくので。
陽極の塩化物イオン(Cl–)が電子を放出して気体の塩素(Cl2)となり、電子は陰極に移動し、銅イオン(Cu2+)が電子を受け取って赤色の銅(Cu)となります。
電子は陽極→陰極と移動していますが、電流は電子の移動の向きとは逆向きに流れるので、電流は陰極→陽極と流れます。
これにより、電流が流れていることが確認できます。
結果として、化学反応式は、CuCl2→Cu+Cl2、となります。
陽極付近では塩素が発生して水に溶けているため、赤インクを陽極付近にたらすと、塩素の漂白作用で赤インクが脱色されます。
問2
答:CuCl2→Cu2++2Cl–
解説:
問1解説参照。
問3
答:ア
解説:
赤色の固体Xは銅です。
銅イオンCu2+と陽イオンより、銅は陰極で発生します。
銅は、陽極側から塩化物イオンCl2-によって供給された電子2個が銅イオンCu2+と結合してできます。
問4
答: 変化:小さくなる。、理由:イオンが少なくなるから。(例)
解説:
塩化銅の電離式は以下のとおりです。
CuCl2→Cu2++2Cl–
化学反応式は、CuCl2→Cu+Cl2です。
電流を流す元となるのは水溶液中にあるイオンです。
電気分解をするとイオンが金属や分子となって減っていくので、電流が小さくなっていきます。
大門5
問1
答:イ
解説:
こまごめピペットの使い方は、この問題を覚えましょう。
問2
答: 反応:中和、起こったもの:①、②、③
解説:
酸性とは、水中にH+があるがOH–が無い状態です。
アルカリ性とは、水中にOH–があるがH+が無い状態です。
水酸化ナトリウムの電離式は、NaOH→Na++OH–より、水中にOH–があるがH+が無い状態なので、うすい水酸化ナトリウム水溶液はアルカリ性です。
BTB溶液は指示薬で、酸性の水溶液に加えると黄色、中性の水溶液に加えると緑色、アルカリ性の水溶液に加えると青色に変化します。
中和とは、酸とアルカリの性質を互いに打ち消し合う反応です。
酸性とアルカリ性の性質を互いに打ち消し合うとは、H+とOH–が反応して水(H2O)になる反応のことです。
中和が起こると、必ず水と塩ができます。
塩は、酸の陰イオンとアルカリの陽イオンが反応してできます。
結果として、化学反応式は、この場合、
HCl+NaOH→NaCl+H2O
となります。
表より、うすい水酸化ナトリウム9cm3に対して、うすい塩酸6cm3で完全に中和することが分かります。
最初はうすい水酸化ナトリウム9cm3のみあり酸性(BTB溶液が青色)なので、アルカリ性→中性(BTB溶液が緑色)まで、つまり①から③まで、中和が起こっています。
水溶液が酸性(BTB溶液が黄色)になると、つまり、④以降、中和が起こりません。
問3
答:Cl–
解説:
塩酸の電離式は「HCl→H++Cl–」、水酸化ナトリウムの電離式は「NaOH→Na++OH–」です。
中和反応として、H++OH–→H2O
塩ができる反応として、Na++Cl–→NaCl
H+とCl–、Na+とOH–の係数の比がすべて1:1、H+とOH–の係数の比も1:1に着目します。
うすい水酸化ナトリウム水溶液にうすい塩酸を加えていくと、H+がOH–と反応して減っていきます。
うすい塩酸のH+とCl–の係数の比がすべて1:1より、うすい塩酸を1回(2cm3)加えると、H+とCl–が1個ずつ加わります。
H+とOH–の係数の比が1:1なので、うすい塩酸を1回(2cm3)加えると、OH–が1個減り、Cl–が1個増え、Na+の数は変わらないことが分かります。
つまり、うすい塩酸を1回(2cm3)ずつ加えると、それに比例して数が増えていくのはCl–です。
全体としては、イオンの個数は変わっていないことにも注意して下さい。
問4
答: 溶液:うすい水酸化ナトリウム水溶液、体積:3cm3
解説:
塩酸の電離式は「HCl→H++Cl–」、水酸化ナトリウムの電離式は「NaOH→Na++OH–」で、H+とCl–、Na+とOH–の係数の比がすべて1:1です。
表の③より、うすい水酸化ナトリウム水溶液:うすい塩酸=9cm3:6cm3=3cm3:2cm3で中和することが分かります。
④ではうすい塩酸が2cm3多い状態なので、実験で用いた濃度のうすい水酸化ナトリウム水溶液3cm3を加えることで、水溶液が中性となり、BTB溶液の色が緑色になります。
大門6

問1
答:イ、ウ、エ
解説:
スケッチの方法として、この問題と解答を覚えましょう。
問2
答: ①:胞子、②シダ(植物)
解説:
植物の分類の観点はまず、種子をつくるか否かで大別します。
種子を作る植物を種子植物といいます。
種子植物はさらに、胚珠が子房に包まれているか否かで分類し、胚珠が子房に包まれている植物を被子植物、胚珠がむきだしの植物を裸子植物といいます。
被子植物はさらに、子葉の枚数で分類し、子葉が1枚の植物を単子葉類、子葉が2枚の植物を双子葉類といいます。
双子葉類は、子葉が2枚、葉脈(葉の維管束)が網状脈、茎の維管束が輪状に並びます。
維管束とは、道管と師管の束のことです。
道管は、根から吸収された水や肥料分が通る管で、茎では維管束の内側にあります。
師管は、葉で光合成で作られた養分(デンプン→ショ糖)が通る管で、茎では維管束の外側にあります。
双子葉類の根は、主根と側根からなり、根の先端ちかくに根毛があり、表面積を広げる構造をしており、これにより水や肥料分を効率よく吸収できます。
単子葉類は、子葉が1枚、葉脈(葉の維管束)が平行脈、茎の維管束が全体に散らばっています。
双子葉類と同じく、道管は維管束の内側に、師管は維管束の外側にあります。
単子葉類の根はひげ根で、根の先端ちかくに根毛があり、表面積を広げる構造をしており、これにより水や肥料分を効率よく吸収できます。
双子葉類はさらに、花弁がくっついているか否かで分類し、花弁がくっついている植物を合弁花類、花弁が離れている植物を離弁花類といいます。
単子葉類として、イネ・トウモロコシ・スズメノカタビラ・ユリ・アヤメ・ツユクサ・チューリップを、
合弁花類として、ツツジ・タンポポ・アサガオを、
離弁花類として、サクラ・アブラナ・エンドウを、
裸子植物として、マツ、スギ、ヒノキ、イチョウ、ソテツを
それぞれ覚えましょう。
これに加えて、ホウセンカは双子葉類であることも覚えましょう。
種子を作らず、胞子で増える植物は、今度は維管束があるかどうか、または、根・茎・葉の区別かあるかどうかで大別され、
維管束がある植物をシダ植物、維管束がない植物をコケ植物といいます。
シダ植物として、イヌワラビ・ゼンマイ・スギナを、
コケ植物として、スギゴケ・ゼニゴケを、
それぞれ覚えましょう。
問3
答:からだの表面全体(例)
解説:
シダ植物とコケ植物の相違点について。
シダ植物は、根・茎・葉(維管束)の区別があり根(ひげ根)で水を吸収します。
コケ植物は、根・茎・葉(維管束)の区別がなく、からだの表面で水を吸収します。また、雄株と雌株に分かれていることが多いです。仮根は水を吸収する力は弱く、主にからだを地面に固定するはたらきをします。
シダ植物とコケ植物の類似点について。
種子ではなく胞子で増える、湿ったところで生育する、葉緑体を持ち光合成をする、雄器で作られた精子が泳ぐために受精には水が必要、の4つです。
問4
答:ア、イ
解説:
外来種であるセイヨウタンポポ、在来種であるカンサイタンポポは、ともに種子植物-被子植物-双子葉類-合弁花類です。
ア:双子葉類の特徴より、正しい
イ:双子葉類の特徴より、正しい
ウ:タンポポは離弁花類です
エ:タンポポは双子葉類より、子葉が2枚です
大門7

問1
答: ゆれ:初期微動、波:P波
解説:
地球は、地殻(大陸部:5〜60㎞、海洋部:5〜10㎞)→マントル→外核→内核でできています。
地球の表層部(地殻とマントルの上部の一部)は、厚さ100kmくらいの固い岩盤で覆われており、この岩盤をプレートといいます。
日本の東北以北では、海洋プレートである太平洋プレートと、日本列島の下にある大陸プレートである北アメリカプレートがあります。
プレートは、年数cmというゆっくりとした速度で、決まった方向に動いています。
海洋プレートは大陸プレートよりも密度が大きいため、太平洋側の海洋プレートが、大陸プレートの下に沈み込むようにしてぶつかり合っています。
大陸プレートと海洋プレートの押し合いにより、日本列島の地下には、強い圧縮の力(ひずみ)がかかっています。
大陸プレートがこのひずみに反発することで、地震が起こります。
これを、海溝型地震(プレート境界地震)といいます。
地震の種類は、海溝型地震(プレート境界地震)と活断層型地震(大陸プレート内地震)の二つがありますが、
入試に出題される地震は、海溝型地震(プレート境界地震)と捉えてもらって結構です。
地震が発生した場所を震源といい、観測地と震源との距離を震源距離といいます。
震源の真上の地表の地点を震央といい、観測地と震央との距離を震央距離といいます。
入試に出題される地震は、震源の深さがごく浅い地震で、震源距離=震央距離と見なして解きます。
地震が発生すると、震源で速さの異なるP波とS波が同時に発生します。
P波の速度はおよそ6〜8m/s、S波の速度はおよそ3〜4m/sと、揺れが到達する速さはP波のほうが速いです。
P波は縦波で、波の進行方向と振動方向が同じであるため、揺れが到達する速さがS波より速いです。
S波は横波で、波の進行方向と振動方向が垂直であるため、揺れが到達する速さがP波より遅いです。
観測地にP波が到達すると、小さなゆれ(初期微動)(A)が始まり、この間の時間を初期微動継続時間といいます。
その後S波が到達して大きなゆれ(主要動)(B)が始まり、しだいにゆれが小さくなって消えます。
問2
答:ウ
解説:
地震の計算問題は、表をタテに読むことがポイントです。
地点1と地点2のP波に着目すると、P波は20km(80km-60km)を3秒で移動するので、P波の速度は20km/3s=20/3km/sです。
地点1において、P波は60kmを、60km÷(20/3km/s)=60×3/20s=3×3=9sで移動します。
つまり、9:27.29の9秒前に地震が発生したと言えるので、地震発生時刻は9:27.20(ウ)です。
問3
答:ア
解説:
初期微動継続時間は、震源距離に比例するので、震源距離の大きい地点3は地点1より初期微動継続時間(Aのゆれの時間)が長くなります。
地震は波で、遠くに伝わるほど振幅が小さくなるので、主要動(Bのゆれの大きさ)が小さくなります。
問4
答:14(秒)
解説:
初期微動継続時間は、震源距離に比例することを利用して解きます。
震源距離60kmにおける初期微動継続時間は6秒より、比例式は、60km:6s=10km:1s=140km:14s
よって、震源距離140kmにおける初期微動継続時間は14秒です。
大門8
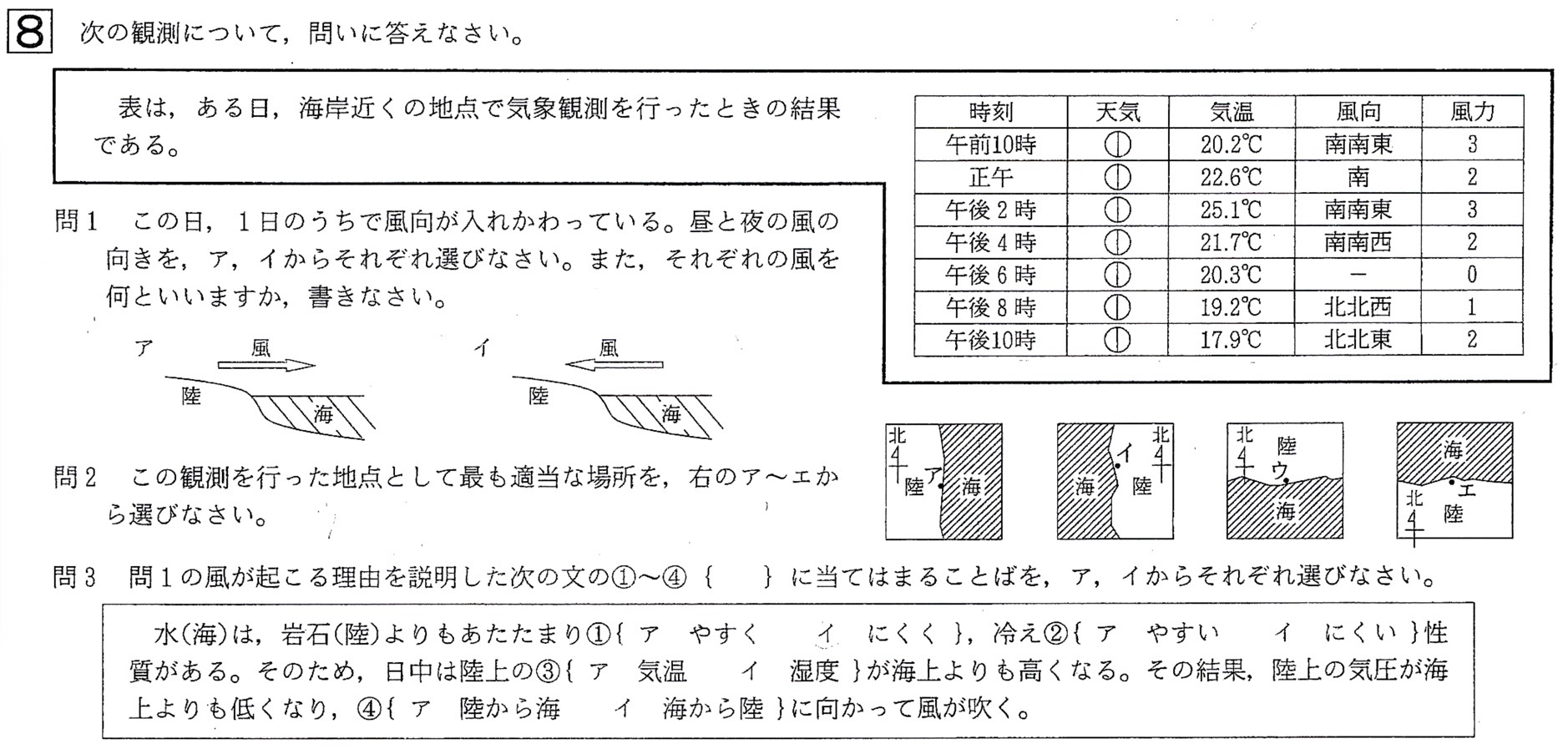
問1
答: 昼→風の向き:イ、風:海風 夜→風の向き:ア、風:陸風
解説:
空気の成分比率は、体積の割合で多い順から
窒素(約78%)、酸素(約21%)、アルゴン(約0.9%)、二酸化炭素(約0.04%)です。
このほか、ネオン、ヘリウムなども微量ですが含まれています。
これらの気体分子(粒子)は、空気中を盛んに動いており、地面などに衝突して圧力(気圧)が生じます。
地面が太陽熱などで暖められると空気は上昇し、それと比較して冷たい場所に空気が流れ、空気が下降します。
空気が上昇すると、その場所では空気を構成する粒子の数が減るため、気圧が減少し、低気圧となります。
空気が下降すると、その場所では空気を構成する粒子が押されて数が増えるため、気圧が上昇し、高気圧となります。
空気は、地表面では冷たい方(高気圧)から温かい方(低気圧)に水平に流れます。
地球の地上10kmまでを対流圏といい、対流がさかんに起こっています。
対流のうち、水平方向の動きを風、垂直方向の動きを気流といいます。
暖かい場所では上昇気流が生じて低気圧となり、上昇した空気は冷たい方に流れ(風)、冷たい場所では下降気流が生じて高気圧となり、地表面では、暖かい場所(低気圧)から冷たい場所(高気圧)に向かって流れます(風)。
固体は液体より冷えやすく暖まりやすいです。
ゆえに、昼間は陸が暖かく海が冷たいので、地表面の風は海から陸に向かって吹きます(イ)。これを陸風といいます。
夜は陸が冷たく海が暖かいので、地表面の風は陸から海に向かって吹きます(ア)。これを海風といいます。
問2
答:ウ
解説:
表より、午前10時〜午後4時までの風向が南寄りなので、風は南から北へ吹きます。
昼間は陸が暖かく海が冷たいので、地表面の風は海から陸に向かって吹きます。
これより、午前10時〜午後4時までの間、風は海(南)から陸(北)へ吹くので、正解はウです。
問3
答: ①:イ、②:イ、③:ア、④:イ
解説:
問1解説参照。
大門9
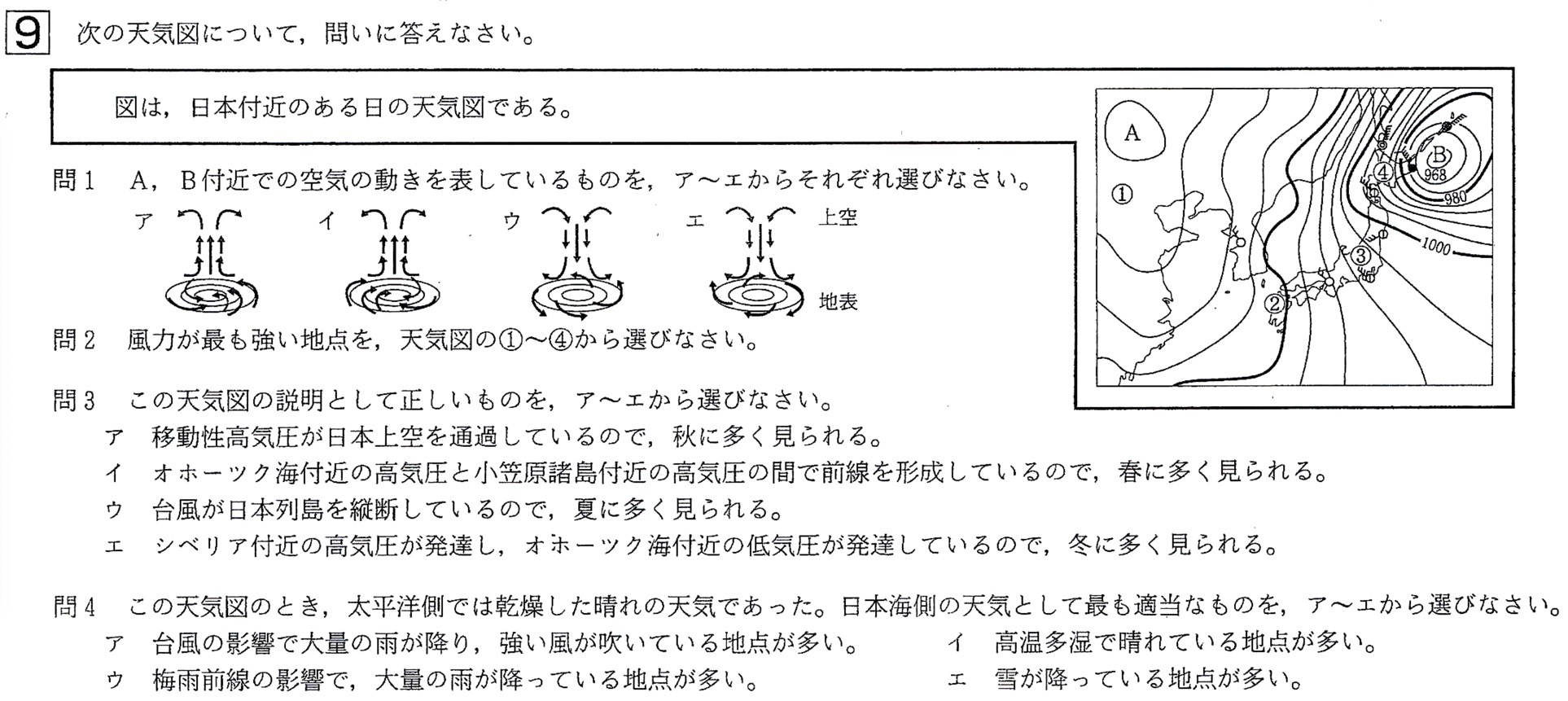
問1
答:A:エ、B:ア
解説:
空気は、冷たい方から温かい方に水平に流れます。
地球の地上10kmまでを対流圏といい、対流がさかんに起こっています。
対流のうち、水平方向の動きを風、垂直方向の動きを気流といいます。
暖かい場所では上昇気流が生じて低気圧となり、上昇した空気は冷たい方に流れ(風)、冷たい場所では下降気流が生じて高気圧となり、地表面では、暖かい場所(低気圧)から冷たい場所(高気圧)に向かって流れます(風)。
地球では、自転速度の差によって生じる右向きの力であるコリオリの力が発生するので、北半球の風向は、等圧線に対して垂直な方向よりも右にそれて吹きます。
そのため、低気圧では反時計回りに風が吹き込み、高気圧では時計回りに風が吹き出します。
冬に発達するシベリア気団(高気圧)について。
宇宙から地球を見ると(これを天体上という)、地球は公転面に垂直な面に対して地軸を23.4°傾けて公転しており、
冬では、地軸の北極側を太陽と反対方向に向けることになるため、
北半球では昼の長さが短く、夜の長さが長くなり、太陽から受ける光エネルギーの量が減少するため、寒くなります。
固体は液体より冷えやすく暖まりやすいです。
ゆえに、冬では、ユーラシア大陸が冷たい場所(高気圧)、日本海や太平洋が暖かい場所(低気圧)となります。
だから冬では、西高東低の気圧配置となります(図)。冬の気圧配置として、等圧線が縦縞となることも覚えましょう。
ユーラシア大陸で発達する高気圧をシベリア気団といい、陸にあるため冷たく乾燥しています。
大陸と海洋でのあたたまりやすさの違いにより、1年周期で風向・風速が変化する風を季節風といいます。
冬は、ユーラシア大陸が冷たい場所(高気圧)、日本海や太平洋が暖かい場所(低気圧)なので、風は、北西のユーラシア大陸から太平洋に向けて吹くため、冬の季節風は北西の風です。
夏に発達する小笠原気団(高気圧)について。
夏では、地軸の北極側を太陽の方向に向けることになるため、北半球では昼の長さが長く、夜の長さが短くなり、太陽から受ける光エネルギーの量が多くなるため、暑くなります。
固体は液体より冷えやすく暖まりやすいです。
ゆえに、夏では、太平洋の南東地域が冷たい場所(高気圧)、日本列島が暖かい場所(低気圧)となります。
だから夏では、南高北低の気圧配置となります。
太平洋の南東地域で発達する高気圧を小笠原気団といい、暖かい場所にあり海にあるため暖かく湿ってしています。
夏は、太平洋の南東地域が冷たい場所(高気圧)、日本列島が暖かい場所(低気圧)なので、
風は、太平洋の南東地域からのユーラシア大陸から太平洋に向けて湿った風が吹くため、夏の季節風は南東の風です。
また、オホーツク海付近では、オホーツク海気団(高気圧)があります。
オホーツク海気団は、冷たい海洋にあるので高気圧で、相対的に暖かい場所である北海道に向けて風が吹きます。
停滞前線は、オホーツク海気団と小笠原気団がほぼつりあい、両者の境にできる前線です。
春から夏にかけて発生する停滞前線を、梅雨前線といいます。
夏は小笠原気団が発達してオホーツク海気団を北へ追いやりますが、秋になると小笠原気団の勢力が弱まり、オホーツク海気団が再び南下してきて、再びオホーツク海気団と小笠原気団がほぼつりあいます。
秋に発生する停滞前線を、秋雨前線といいます。
気圧の等しい地点を結んだときにできる線を、等圧線といいます。
等圧線は全体としてなめらかな曲線となり、途中で枝分かれしたり、消えてなくなったりすることはありません。
等圧線は、1000hPaを基準にして、4hPaごとに細い線が引かれ、20hPaごとに太い線が引かれます。
高気圧は、等圧線が丸く閉じている部分で、中心にいくほど気圧が高くなります。
低気圧は、等圧線が丸く閉じている部分で、中心にいくほど気圧が低くなります。
また低気圧は、等圧線の間隔がせまく、距離に対しての気圧の変化である気圧傾度が大きいため、風が強く吹き込みます。
以上の知識をもとに、問題を解きます。
図は、等圧線が日本列島付近で縦縞です。
また、Aの等圧線の間隔が広く、Bの等圧線の間隔が狭くかつ中心にいくほど気圧が低くなっていることから、Aは高気圧、Bは低気圧と、西高東低の気圧配置です。
これより、図の気圧配置は冬です。
高気圧(A)では下降気流が生じて、風が時計回りに吹き出します(エ)
低気圧(B)では上昇気流が生じて、風が反時計回りに吹き込みます(ア)
問2
答:④
解説:
低気圧は、等圧線の間隔がせまく、距離に対しての気圧の変化である気圧傾度が大きいため、風が強く吹き込みます。
問3
答:エ
解説:
図は、等圧線が日本列島付近で縦縞です。
また、Aの等圧線の間隔が広く、Bの等圧線の間隔が狭くかつ中心にいくほど気圧が低くなっていることから、Aは高気圧、Bは低気圧と、西高東低の気圧配置です。
これより、図の気圧配置は冬です。
問4
答:エ
解説:
冬の季節風はユーラシア大陸の冷たく乾燥した風であるため、日本海を通過するときに熱と水蒸気を吸収し、日本列島の山脈にぶつかって、フェーン現象により、日本海側に大雪を降らせ、太平洋側に乾燥した風が吹きます。
大門10
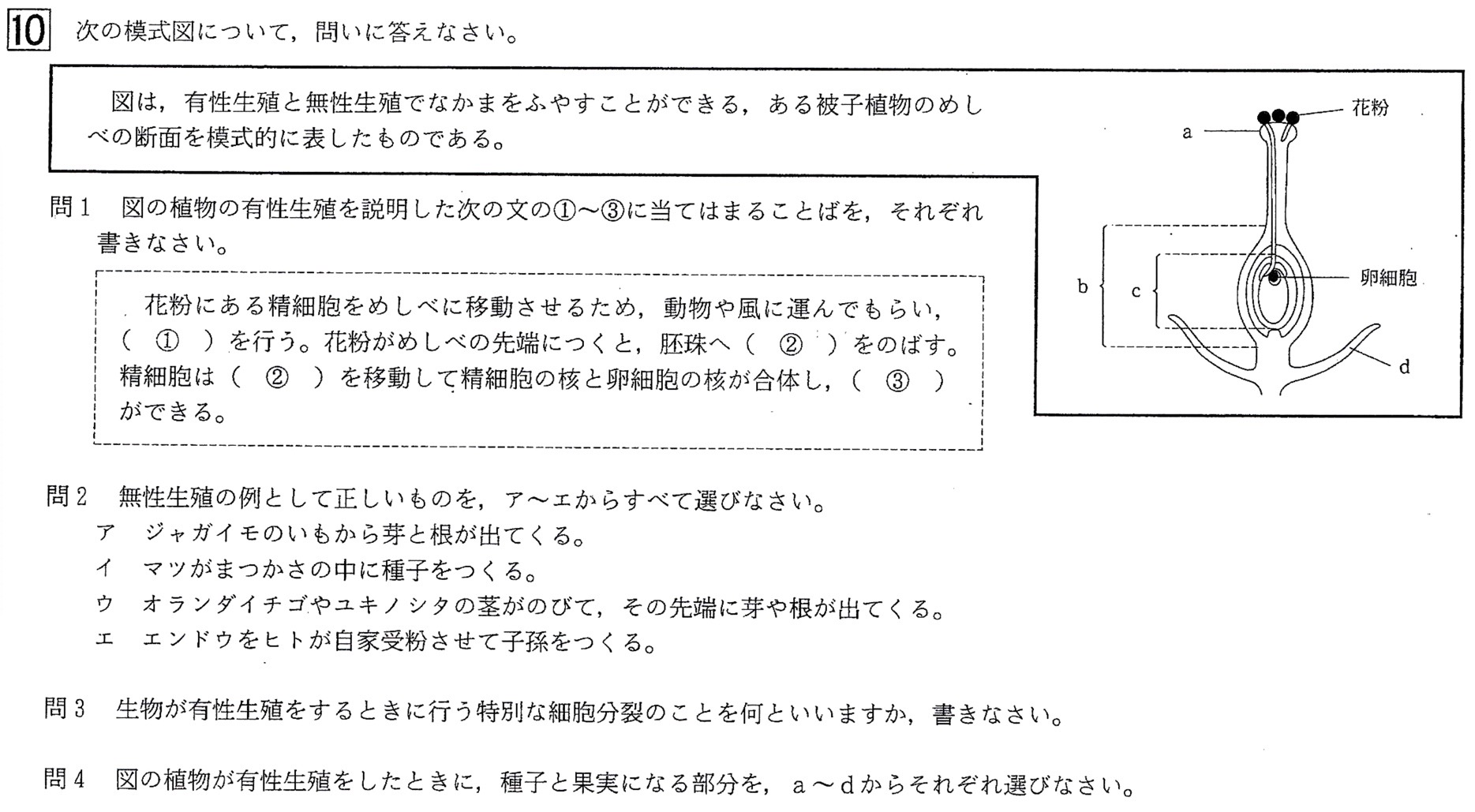
問1
答: ①:受粉、②:花粉管、③:受精卵
解説:
細胞分裂には、体細胞分裂と減数分裂があります。
からだをつくる細胞が分裂する細胞分裂を、体細胞分裂といいます。
体細胞分裂では、分裂前と分裂後の細胞の染色体の数は変わりません。
生殖細胞(精子や精細胞、卵や卵細胞)がつくられるときの細胞分裂を、減数分裂といいます。
減数分裂では、分裂後の細胞の染色体の数は、分裂前の半分になります。
例えば、雌(めしべ)の遺伝子型がAAのとき、生殖細胞である卵(卵細胞)は、AとAに減数分裂します。
雄(おしべ)の遺伝子型がaaのとき、生殖細胞である精子(精細胞)は、aとaに減数分裂します。
卵(卵細胞)と精子(精細胞)の核が合体することを受精といい、この場合、子の遺伝子型はAaとなり、両親から遺伝子を半分ずつ受け継ぎます。
このように、減数分裂で生じる生殖細胞の受精により、新個体(子)をふやすふやし方を、有性生殖といいます。
なお、生殖細胞の呼び方は、被子植物の場合は精細胞と卵細胞、動物の場合は精子と卵です。
■被子植物の有性生殖
花の4要素は、外側から、がく・花弁・おしべ・めしべの順です。
おしべのやくにの中には花粉母細胞(核相2n)があり、そこから成熟花粉(核相n、生殖細胞(精細胞)なので減数分裂して染色体の数が半分になっている)が作られます。
花粉がめしべの柱頭に付着することが受粉で、受粉後、花粉管(a)の伸張により精細胞が胚珠の中の卵細胞(核相n)と受精し受精卵となります。
受精後、胚珠(c)は種子に、子房(b)は果実に、受精卵は胚となります。
■カエルの有性生殖
雌の生殖細胞である卵(卵巣にある)と雄の生殖細胞である精子(精巣にある)が受精して、受精卵ができます。
受精卵が細胞分裂を繰り返して胚(動物では、自分で食物をとることができる個体となる前のもの)になり、さらに細胞分裂をくり返して個体へと変化していくことを発生といいます。
問2
答:ア、ウ
解説:
無性生殖とは、受精せずに仲間(子)を増やす増やし方です。
無性生殖には、
1個体が2個体以上に分かれて増える「分裂」、
親のからだの一部に突起ができ、それが大きくなって親から分かれて増える「出芽」、
根や茎や葉の一部から新しい個体が生じて増える「栄養生殖」(ア、ウ)、
があります。
問3
答:減数分裂
解説:
問1解説参照。
問4
答: 種子:c、果実:b
解説:
受精後、胚珠(c)は種子に、子房(b)は果実に、受精卵は胚となります。
大門11
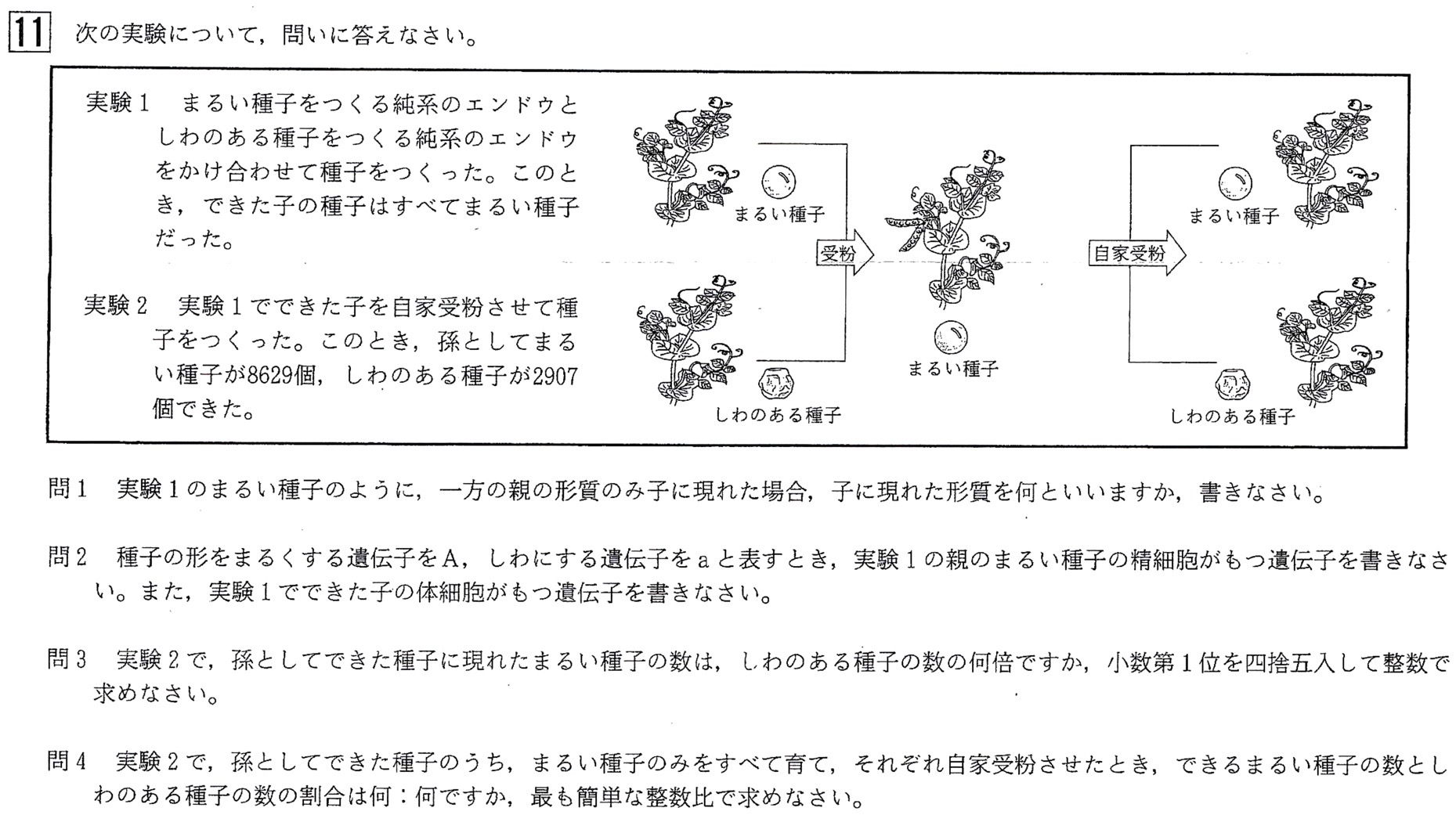
問1
答:優性(形質)
解説:
例えば、雌(めしべ)の遺伝子型がAAのとき、生殖細胞である卵(卵細胞)は、AとAに減数分裂します。
雄(おしべ)の遺伝子型がaaのとき、生殖細胞である精子(精細胞)は、aとaに減数分裂します。
卵(卵細胞)と精子(精細胞)の核が合体することを受精といい、この場合、子の遺伝子型はAaとなり、両親から遺伝子を半分ずつ受け継ぎます。
このように、減数分裂で生じる生殖細胞の受精により、新個体(子)をふやすふやし方を、有性生殖といいます。
なお、生殖細胞の呼び方は、被子植物の場合は精細胞と卵細胞、動物の場合は精子と卵です。
まず、この考え方をしっかり押さえてください。
■メンデルの3法則
①優性の法則
対立形質(丸形かしわ形か、など)をもつ純系(遺伝子型AA、aa)の親どうしを交配させてえられる子(雑種第一代F1)は、すべて優性形質(遺伝子A)のみが現れるという法則です。
このとき現れなかった形質を、劣性形質(遺伝子型a)といいます。
②分離の法則
減数分裂で生殖細胞をつくるとき、対立遺伝子は別々の生殖細胞に入るという法則です。
③独立の法則
2組以上の対立形質に関する遺伝では、それぞれの対立遺伝子は互いに関係なく独立に遺伝するという法則です。
問2
答: 精細胞:A、体細胞:Aa
解説:
問1解説参照。
問3
答:3倍
解説:
まるい種子=8629個≒8700個、しわのある種子=2907個≒2900個より、
まるい種子:しわのある種子=8700:2900=3:1という比がなりたつので、まるい種子の数はしわのある種子の約3倍です。
問4(難)
答: まる:しわ=5:1
解説:
遺伝子型Aaどうしを交配させて得られる子の遺伝子型は、
Aa×Aa→AA、Aa、AA、aa、です。
これを中3の式の展開の考え方で求めることができます。
(A+a)(A+a)=AA+Aa+Aa+aa
以上の知識をもとに、問題を解きます。
問題文に「丸い種子をつくる純系のエンドウとしわのある種子をつくる純系のエンドウをかけあわせて種子を作った。このとき、できた子の種子はすべてまるい種子だった。」とあるので、
丸い種子になる遺伝子Aが優性形質、しわのある種子になる遺伝子aが劣性形質となり、遺伝子の組み合わせは
AA×aa→Aa、Aa、Aa、Aa→Aa
と、すべてAaで丸い種子となります。
この遺伝子型Aaの丸い種子を組み合わせてできる遺伝子の組み合わせは、
Aa×Aa→AA、Aa、AA、aa
です。
この結果から、
・丸形の種子:しわ形の種子=3:1
・AA:Aa:aa=1:2:1
であることが分かります。
以上の知識をもとに、問題を解きます。
孫の代の種子の遺伝子の組み合わせは、
Aa×Aa→AA、Aa、Aa、aa
この中で、まるい種子の遺伝子型はAAとAaで、AA:Aa=1:2です。
自家受粉を大量に行うと、遺伝子の組み合わせは以下のように集約できます。
AA×AA→AA、AA、AA、AA(まるい種子:しわのある種子=4:0)
Aa×Aa→AA、Aa、AA、aa(まるい種子:しわのある種子=3:1=6:2 ※AA:Aa=1:2より、比を2倍する)
2つの比を足すと、
まるい種子:しわのある種子=4+6:0+2=10:2=5:1